Краткая характеристика элементов подгруппы хрома

Подгруппа хрома является побочной подгруппой VI группы периодической системы элементов Д.И. Менделеева. В подгруппу входят хром Cr, молибден Mo, вольфрам W.
Эти элементы относятся также к числу переходных металлов, т.к. у них застраивается d-подуровень предвнешнего слоя. Во внешнем слое атомов этих элементов имеется один (у хрома и молибдена) или два (у вольфрама) электрона. Таким образом, атомы элементов подгруппы хрома имеют шесть валентных электронов, способных участвовать в образовании химической связи (см. табл. 30).
Хром, молибден, вольфрам похожи по многим физическим и химическим свойствам: так, в виде простых веществ все они представляют собой тугоплавкие серебристо-белые металлы, обладающие большой твердостью и рядом ценных механических свойств — способностью к прокатыванию, протягиванию и штамповке.
С химической точки зрения все металлы подгруппы хрома устойчивы к действию воздуха и воды (при обычных условиях), при нагревании все они взаимодействуют с кислородом, галогенами, фосфором, углеродом.
Под действием концентрированных кислот (HNO3, H2SO4) при обычной температуре металлы подгруппы хрома пассивируются.
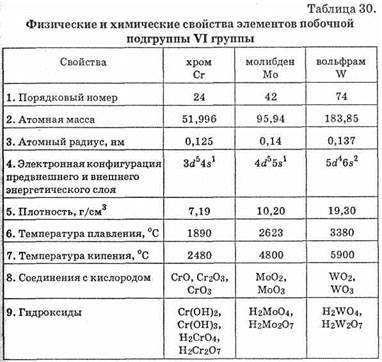
Для всех элементов подгруппы хрома наиболее типичны соединения, где их степени окисления бывают +2, +3, +6 (хотя есть соединения, где их степени могут быть также +4 и +5, а у хрома и +1). У элементов подгруппы хрома не бывает отрицательной степени окисления, и они не образуют летучих водородных соединений. Твердые гидриды, такие, как CrH3, известны только для хрома. Соединения двухвалентных элементов неустойчивы и легко окисляются до более высоких степеней окисления.
С увеличением степени окисления усиливается кислотный характер оксидов, с максимальной степенью окисления +6 образуются оксиды типа RO3, которым соответствуют кислоты H2RO4. Сила кислот закономерно снижается от хрома к вольфраму. Большинство солей этих кислот в воде малорастворимы, хорошо растворяются только соли щелочных металлов и аммония.
Как и в других случаях, у элементов подгруппы хрома с возрастанием порядкового номера усиливаются металлические свой-
ства. Химическая активность металлов в ряду хром — молибден — вольфрам заметно понижается.
Все металлы подгруппы хрома широко используются в современной технике, в особенности в металлургической промышленности для производства специальных сталей.
Хром
Нахождение в природе
Хром относится к достаточно распространенным элементам, содержание его в земной коре составляет примерно 0,02% (22-е место). Встречается хром исключительно в соединениях, основными минералами являются хромит FeCr2O4 (или FeO•Cr2O3), или хромистый железняк, и крокоит PbCtO4 (или PbO•CrO3). Окраска многих элементов обусловлена присутствием в них хрома. Так, например, золотисто-зеленый тон изумруду или красный — рубину придает примесь оксида хрома Cr2O3.
Получение
Сырьем для промышленного получения хрома служит хромистый железняк. Его химическая переработка приводит к Cr2O3. Восстановление Cr2O3 с помощью алюминия или кремния дает металлический хром невысокой степени чистоты:
Cr2O3+Аl=Аl2O3+2Cr
2Cr2O3+3Si=3SiO2+4Cr
Более чистый металл получают электролизом концентрированных растворов соединений хрома.
Дата добавления: 2016-01-03; просмотров: 5376;
