Оксиды хрома (II), (III) и (VI)
Хром образует три оксида: CrO, Cr2O3, CrO3.
Оксид хрома (II) CrO — пирофорный черный порошок. Обладает основными свойствами.
В окислительно-восстановительных реакциях ведет себя как восстановитель:
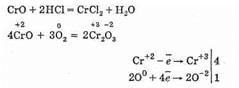
CrO получают разложением в вакууме карбонила хрома Cr(СО)6 при 300°С.
Оксид хрома (III) Cr2O3 — тугоплавкий порошок зеленого цвета. По твердости близок к корунду, поэтому его вводят в состав полирующих средств. Образуется при взаимодействии Cr и O2при высокой температуре. В лаборатории оксид хрома (III) можно получить нагреванием дихромата аммония:
(N-3H4)2Cr+62O7=Cr+32O3+N02+4Н2О
Оксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Cr2O3+3H2SO4=Cr2(SO4)3+3Н2О
При взаимодействии с щелочами в расплаве образуются соединения хрома (III) — хромиты (в отсутствие кислорода): Cr2O3+2NaOH=2NaCrO2+Н2О
В воде оксид хрома (III) нерастворим.
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель:
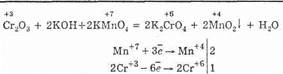
Оксид хрома (VI) CrO3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. При нагревании около 200°С разлагается:
4CrO3=2Cr2O3+3O2
Легко растворяется в воде, имея кислотный характер, образует хромовые кислоты. С избытком воды образуется хромовая кислота H2CrO4:
CrO3+Н2O=Н2CrO4
При большой концентрации CrO3 образуется дихромовая кислота Н2Cr2О7:
2CrO3+Н2О=Н2Cr2О7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7+Н2О=2Н2CrO4
Хромовые кислоты существуют только в водном растворе, ни одна из этих кислот в свободном состоянии не выделена. Однако соли их весьма устойчивы.
Оксид хрома (VI) является сильным окислителем:
3S+4CrO3=3SO2+2Cr2O3
Окисляет иод, серу, фосфор, уголь, превращаясь в Cr2O3. Получают CrO3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na2Cr2O7+2H2SO4=2CrO3+2NaHSO4+H2O Следует отметить сильную токсичность оксида хрома (VI).
Дата добавления: 2016-01-03; просмотров: 14055;
