Физические свойства. Хром — металл серо-стального цвета, твердый, довольно тяжелый (r=7,19 г/см3), пластичный, ковкий, плавится при 1890°С
Хром — металл серо-стального цвета, твердый, довольно тяжелый (r=7,19 г/см3), пластичный, ковкий, плавится при 1890°С, кипит при 2480°С. В природе встречается в виде смеси четырех стабильных изотопов с массовыми числами 50, 52, 53 и 54. Наиболее распространен изотоп 52Cr (83,76%).
Химические свойства
Расположение электронов на 3d- и 4s-орбиталях атома хрома можно представить схемой:
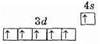
Отсюда видно, что хром может проявлять в соединениях различные степени окисления от +1 до +6; из них наиболее устойчивы соединения хрома со степенями окисления +2, +3, +6. Таким образом, в образовании химических связей участвует не только s-электрон внешнего уровня, но и пять d-электронов предвнешнего уровня.
При обычных условиях хром устойчив по отношению к кислороду, воде, а также к некоторым другим химическим реагентам. При высоких температурах хром горит в кислороде:
4Cr+3O2=2Cr2O3
В раскаленном состоянии реагирует с парами воды:
2Cr+3Н2O=Cr2O3+3H2
Металлический хром при нагревании реагирует также с галогенами, серой, азотом, фосфором, углем, кремнием и бором. Например: 2Cr+N2=2CrN 2Cr+3S=Cr2S3 Cr+2Si=CrSi2
Металл растворяется при обычной температуре в разбавленных кислотах (НСl, H2SO4) с выделением водорода. В этих случаях в отсутствие воздуха образуются соли хрома (II):
Cr+2HCl=CrCl2+H2 А на воздухе — соли хрома (III): 4Cr+12НCl+3О2=4CrСl+6Н2O
Если же металл погрузить на некоторое время в азотную кислоту (концентрированную или разбавленную), то он перестает растворяться в НСl и в H2SO4, не изменяется при нагревании с галогенами и т.д. Это явление — пассивирование — объясняется образованием на поверхности металла защитного слоя — очень плотной и механически прочной (хотя и очень тонкой) пленки оксида хрома Cr2O3.
Применение
Основной потребитель хрома — металлургия. Сталь при добавлении хрома становится гораздо более стойкой к действию химических реагентов; повышаются и такие важные свойства стали, как прочность, твердость и износостойкость. Электролитическое покрытие хромом железных изделий (хромирование) также сообщает им устойчивость к коррозии.
Семейство хромовых сплавов весьма многочисленно. Нихромы (сплавы с никелем) и хромали (с алюминием и железом) устой-
чивы, обладают высоким сопротивлением и используются для изготовления нагревателей в электрических печах сопротивления. Стеллит — сплав хрома (20-25%), кобальта (45-60%), вольфрама (5-20% ), железа (1-3%) — очень тверд, стоек против износа и коррозии; применяется в металлоперерабатывающей промышленности для изготовления режущих инструментов. Хромомолибденовые стали используются для создания фюзеляжей самолетов.
Дата добавления: 2016-01-03; просмотров: 2705;
