Оксиды, пероксиды, гидроксиды и соли щелочных металлов на примере натрия и калия
Оксиды натрия и калия особого значения не имеют. Они энергично реагируют с водой, образуя едкий натр и едкое кали соответственно:
Na2O+Н2O=2NaOH
К2O+Н2O=2КОН
Они проявляют все свойства основных оксидов.
Пероксид натрия Na2O2 — желтоватый порошок. Его можно рассматривать как своеобразную соль пероксида водорода, ибо его структура такая же, как у Н2О2. Как и пероксид водорода, перок-
сид натрия является сильнейшим окислителем. При растворении в воде он образует щелочь, пероксид водорода и кислород:
5Na2O2+6Н2O=Н2О2+10NaOH+2O2
Пероксид водорода образуется и при действии разбавленных кислот на пероксид натрия:
Na2O2+H2SO4=Na2SO4+Н2O2
С углекислым газом воздуха пероксид натрия реагирует по уравнению:
2Na2O2+2СO2=2Na2CO3+O2
Поэтому его используют в дыхательных аппаратах для регенерации воздуха — поглощения оксида углерода (IV) и выделения кислорода.
Пероксид натрия, кроме того, применяется для отбеливания тканей, кости, волос и др.
Очень важными соединениями являются гидроксид натрия, или едкий натр NaOH, его называют также каустической содой или каустиком, и гидроксид калия, или едкое кали КОН. Их также называют едкими щелочами, т.к. они хорошо растворимы в воде.
Гидроксид калия и гидроксид натрия — белые непрозрачные твердые кристаллические вещества. В воде растворяются с выделением большого количества теплоты.
В водных растворах практически нацело диссоциированы и являются сильными щелочами:
NaOH«Na++ОН-КОН«К++ОН-
Проявляют все свойства оснований.
Твердые гидроксиды натрия и калия и их водные растворы поглощают оксид углерода (IV):
NaOH+СO2=NaHCO3 2NaOH+СO2=Na2CO3+Н2O
В твердом состоянии на воздухе NaOH и КОН поглощают влагу, благодаря чему их используют как осушители газов.
В промышленности гидроксид натрия и гидроксид калия получают электролизом концентрированных растворов NaCl и КС1. При этом одновременно получается хлор и водород. Катодом служит сетка, анодом — графит.
Схема электролиза:
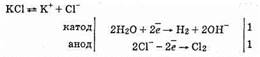
Калии в ряду стандартных электродных потенциалов расположен до алюминия, и его ионы восстанавливаются гораздо труднее, чем молекулы воды. Ионов Н+ в растворе очень мало. Поэтому на катоде разряжаются только молекулы воды с выделением молекулярного водорода. Хлорид-ионы в концентрированном растворе легче отдают электроны (окисляются), чем молекулы воды, поэтому на аноде разряжаются хлорид-ионы.
Общее уравнение электролиза в ионной форме:
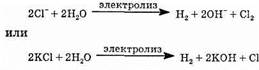
Аналогично протекает электролиз раствора NaCl. Раствор, содержащий NaOH и NaCl, подвергается упариванию, в результате чего выпадает в осадок хлорид натрия (он имеет намного меньшую растворимость и она мало изменяется с температурой), который отделяют и используют для дальнейшего электролиза.
Анодное и катодное пространство разделено диафрагмой для того, чтобы образующиеся продукты не вступали между собой во взаимодействие, например:
Сl2+NaOH=NaClO+NaCl+Н2О
Едкий натр применяют во многих отраслях промышленности, например, для очистки нефти, производства мыла из жиров, в бумажной промышленности, в производстве искусственного волокна и красителей, производства медикаментов, в быту и др.
Более дорогой продукт — гидроксид калия — применяется реже, чем NaOH.
Натрий и калий образуют соли со всеми кислотами. Почти все их соли растворимы в воде. Важнейшие из них следующие.
Хлорид натрия NaCl — необходимая приправа к пище, используется для консервирования пищевых продуктов, а также служит сырьем для получения гидроксида натрия, хлора, соляной кислоты, соды и др.
Применение соды — см. табл. 25 на стр. 303.
Сульфат натрия Na2SO4 применяют в производстве соды и стекла. Из водных растворов кристаллизуется десятиводный гид-
рат Na2SO4•10Н2О, называемый глауберовой солью. Применяют в медицине как слабительное.
Соли калия следует отметить особо, так как некоторые из них широко используются в качестве удобрений:
1) сырые соли, представляющие собой размолотые природные соли, преимущественно минералы сильвинит NaCl•КСl и каинит КСl•MgSO4•3Н2O;
2) концентрированные удобрения, получаемые в результате переработки природных калийных солей, — это КСl и K2SO4;
3) древесная и торфяная зола, содержащие поташ K2CO3.
Дата добавления: 2016-01-03; просмотров: 4168;
