Общая характеристика щелочных металлов
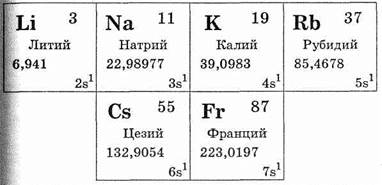
В группу щелочных металлов входит следующий ряд элементов: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs, франций Fr. Они находятся в главной подгруппе I группы периодической системы. Все эти металлы сходны в том отношении, что на их внешнем электронном слое имеется один электрон (см. табл. 28). Щелочные металлы относятся к числу s-элементов. Электрон внешнего электронного слоя атома щелочного металла по сравнению с другими элементами того же периода удален от ядра, т.е. радиус атома щелочного металла наибольший по сравнению с радиусом атомов элементов того же периода. В связи с этим валентный электрон внешнего слоя атомов щелочных металлов легко отрывается, превращая их в положительно однозарядные ионы. Этим обусловлено то, что соединения щелочных металлов с другими элементами построены по типу ионной связи.
В окислительно-восстановительных реакциях щелочные металлы ведут себя как сильные восстановители, и эта способность Возрастает от металла к металлу с увеличением заряда ядра атома.
Таблица 28.
Физические и химические свойства элементов главной подгруппы I группы
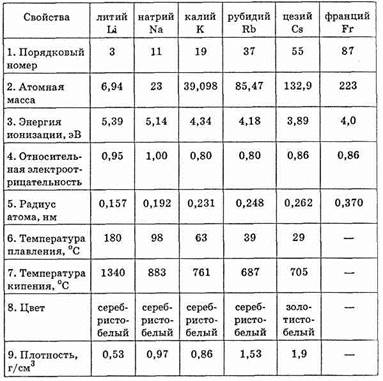
Среди металлов щелочные металлы проявляют наиболее высокую химическую активность. В ряду напряжений все щелочные металлы располагаются в начале ряда. Электрон внешнего электронного уровня является единственным валентным электроном, поэтому щелочные металлы в любых соединениях одновалентны. Степень окисления щелочных металлов обычно +1.
Щелочные металлы легко окисляются на воздухе, в воде и кислотах. Чтобы предотвратить окисление, их хранят в закрытых (вакуумированных) сосудах или под слоем эфира, керосина и т.п. Окисление щелочных металлов в атмосфере кислорода протекает очень энергично, причем образуется при этом пероксид металла типа R2O2. Оксиды могут быть получены только при соблюдении особых условий.
Оксиды щелочных металлов R2O обладают ярко выраженными основными свойствами, активно реагируют с водой, кислотами и кислотными оксидами.
При взаимодействии щелочных металлов или их оксидов с водой образуются гидроксиды щелочных металлов — щелочи ROH — это сильные основания, основные свойства которых возрастают с увеличением атомного номера элемента. Восстановительные свойства щелочных металлов выражены настолько сильно, что при нагревании их в атмосфере водорода образуются гидриды, в которых степень окисления водорода равна -1. Водородные соединения щелочных металлов отвечают формуле RH. Это белые кристаллические вещества.
Дата добавления: 2016-01-03; просмотров: 2670;
