Лекция № 5 - Внутри- и межмолекулярное взаимодействие
Механизмы взаимодействия групп атомов в молекуле и различных молекул между собой в целом идентичны.
Между атомами в молекулах низкомолекулярных органических веществ, в звеньях полимеров и между звеньями цепи существуют химическиековалентные связи, относимые к сильному взаимодействию.
Между молекулами низкомолекулярных соединений, между макромолекулами полимеров и между участками одной и той же полимерной цепи существует нехимическое взаимодействие (межмолекулярное и внутримолекулярное), не приводящее к образованию новых химических связей и относящееся к слабому взаимодействию.
Нехимическое взаимодействие определяет агрегатное и фазовое состояние, а также физические свойства вещества.Рассмотрим эти виды взаимодействия.
1. Электростатические силы притяжения (силы Ван-дер-Ваальса) и силы отталкивания) - взаимодействие нейтральных молекул. Электростатическое притяжение между ядрами одной молекулы и электронами другой частично компенсируются взаимным отталкиванием ядер и электронов обеих молекул. Действуют на близком расстоянии (0.3-0.5) нм и быстро ослабевают при удалении молекул друг от друга. При значительном сближении молекул переходят в специфический тип взаимодействия –обменный, определяемый квантовыми механизмами. Энергия этого взаимодействия - Еобм .
2. Ориентационное (или диполь-дипольное) взаимодействие – взаимодействие полярных молекул, обусловленное наличием в них постоянных диполей. Действует на относительно большом расстоянии. В твердых полимерах:
Едип ~ 1 / r3 ~ 1 / Т,где Е–энергия взаимодействия, r – расстояние между молекулами, Т – температура, которая оказывает дезориентирующее воздействие.
3. Поляризационное (индукционное) взаимодействие– наблюдается между постоянным диполем полярной молекулы и индуцированным (наведенным) диполем неполярной молекулы. Проявляется на малых расстояниях. Епол ~ 1 / r6.
4. Дисперсионное взаимодействие – носит универсальный характер и возникает между молекулами независимо от их полярности. Обусловлено квантовомеханическими флуктуациями электронной плотности, которые приводят к образованию мгновенных диполей в молекуле, которые в свою очередь индуцируют перераспределение электронной плотности в другой молекуле. Энергия притяжения между подобными мгновенными диполями проявляется на малых расстояниях: Едисп ~ 1 / r6.
В общем, виде суммарная энергия при наличии перечисленных видов взаимодействия:
Еå = Едип + Епол + Едисп + Еобм .
У слабополярных молекул первые два члена значительно меньше третьего, который и обуславливает притяжение. У сильнополярных молекул основной вклад во взаимное притяжение вносит энергия диполь-дипольного взаимодействия.
5.Помимо перечисленных видов взаимодействия существует еще одно – особое. Водородная связь (Н-связь)– возникает между двумя электроотрицательными атомами через атом водорода. Ее суть. ® Атом водорода, ковалентно связанный с электроотрицательным атомом, несет относительно высокий положительный заряд и электростатически притягивается электроотрицательным атомом другой молекулы с образованием водородной связи.
○
→│2, 73 А │←
ОH . . . . О
/ \\
Н – С С – Н
\\ /
О . . . . НО ○
→│ │← 1 А
В квантовой химии комплекс, имеющий Н-связь, рассматривается, как единая квантовая система с наиболее энергетически выгодным расположением электронов. Возможность образования Н-связи во многом определяется малым размером атома водорода, позволяющим подойти к другим атомам на очень близкое расстояние.
Энергия водородной связи определяется электроотрицательностью атомов, в зависимости от величины которой атомы можно расположить в ряд:
F > О > N, Cl > S, C.
Т.е. Н-связи характерны для групп типа: –ОН, -NH (например, целлюлоза и биополимер хитозан) и др. Для образование водородной связи электроотрицательные атомы должны сблизиться на определенное расстояние порядка (0.25 – 0.30) нм. По энергии водородные связи условно подразделяют на «слабые» (<15 кДж/моль), “средние” (15 – 30 кДж/моль) и «сильные» (до 60 – 80 кДж/моль). В органических соединениях Н-связи обычно относятся к слабым и средним, но и они достаточно сильны, особенно в целлюлозе:
.
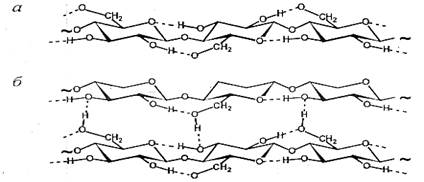 Пример а - внутри- и б- межмолекулярных водородных связей в целлюлозе
Пример а - внутри- и б- межмолекулярных водородных связей в целлюлозе
Дата добавления: 2016-01-03; просмотров: 2795;
