Уравнение Менделеева-Клапейрона
Объединив последние три закона, легко получить объединенный газовый закон:
P1V1/T1=P2V2/T2 или PV/T=const при m=const Этот закон пока не общий — константа будет разной для одинаковых масс разных газов. Однако если учесть закон Авогадро, связывающий общим свойством все газы, получим, что для любого газа
PV/T=(m/M)•const,
причем теперь константа общая для всех газов. Чему она равна? Экспериментальным путем было установлено, что при нормальных условиях (P=I атм=1,013•105 Па, Т=273 К) один моль любого газа занимает один и тот же объем, а именно 22,4 л. Подставляя эти значения в полученное нами уравнение и учитывая,
m что — — это количество моль, получаем, что значение константы
8,3144 Дж/(моль•К). Ее называют универсальной газовой постоянной и обозначают символом R.
Таким образом, мы получили универсальное уравнение, связывающее все параметры, характеризующие состояние газообразного вещества. Оно называется уравнением Менделеева-Клапейрона.
PV =(m/M)RT Используя это уравнение, можно найти любой неизвестный параметр для любого газа, если известны остальные. Рассмотрим два практически важных следствия из этого уравнения.
1. Легко видеть, что при постоянных давлении и температуре плотность газа
р=m/V=const•М,
то есть плотность любого газа при одинаковых условиях зависит только от его молекулярной массы. Это позволяет найти молекулярную массу неизвестного газа, если известна его относительная плотность
D=r1/r2.
по газу с известной молекулярной массой, ведь
D=M1/M2.
Так, если относительная плотность газа по водороду составляет 22, то его молекулярная масса 44 (углекислый газ). Часто используется относительная плотность по воздуху. При этом молекулярная масса воздуха принимается равной 29.
2. Также легко вывести из уравнения Менделеева-Клапейрона тот I факт, что если реакция с участием газов происходит в замкнутом сосуде при постоянной температуре, то давление в сосуде
прямо пропорционально общему количеству молей газов.
3. Универсальность свойств газов позволяет ввести понятие средней молекулярной массы для смеси газов (оно часто используется в задачах). Если ввести обозначение
v=m/M — (количество моль), то средняя молекулярная масса:
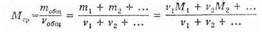
Поскольку газы в смеси всегда находятся при одинаковых условиях, то к ним применим закон Авогадро, и определение средней молярной массы можно переписать, заменив число молей на объем:
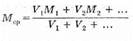
Дата добавления: 2016-01-03; просмотров: 1023;
