Закон Авогадро, молярный объем
Поскольку газы являются наиболее простым объектом исследования, то их свойства и реакции между газообразными веществами изучены наиболее полно.
Французский ученый Ж, Л. Гей-Люссак установил закон объемных отношений:

Например, 1 л хлора соединяется с 1 л водорода, образуя 2 л хлороводорода; 2 л оксида серы (IV) соединяются с 1 л кислорода, Образуя 2 л оксида серы (VI).
Этот закон позволил итальянскому ученому А. Авогадро предположить, что молекулы простых газов (водорода, кислорода, азота, хлора и т.д.) состоят из двух одинаковых атомов. При соединении водорода с хлором их молекулы распадаются на атомы; а последние образуют молекулы хлороводорода. Но поскольку из одной молекулы образуются две молекулы хлороводорода, объем последнего должен быть равен сумме объемов исходных газов, т.е.
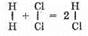
Таким образом, объемные отношения легко объясняются, если исходить из представления о двухатомности молекул простых газов (Н2, Сl2, О2, N2 и др.). Это служит, в свою очередь, доказательством двухатомности молекул этих веществ.
Изучение свойств газов позволило А. Авогадро высказать гипотезу, которая впоследствии была подтверждена опытными данными, а потому стала называться законом Авогадро:

Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Этот объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, т.е. температуре 273 К (0° С) и давлении 101325 Па, масса 1 л водорода равна 0,09 г, молярная масса его равна 1,008 • 2 = 2,016 г/моль. Тогда объем, занимаемый 1 молем водорода, равен
2,016 г/моль
(2,016 г/моль)/0,09 г/л=22,4 л/моль.
При тех же условиях масса 1 л кислорода 1,429 г; молярная масса 32 г/моль. Тогда объем равен
32 г/моль/1,429 г/л =22,4 л/моль.
Следовательно,

1Точное значение 22,4135±0,0006 л/моль
где Vm — молярный объем газа (размерность м3/моль или л/моль); V — объем вещества системы; n — количество вещества системы. Пример записи: Vm газа (н.у.) »22,4 л/моль.
Вспомним, что в 1860 г. на международном съезде химиков в Карлсруэ учение А. Авогадро получило всеобщее признание.
Съезд дал сильный толчок развитию атомно-молекулярного учения. Но особенно бурное развитие оно получило после открытия Д. И. Менделеевым периодического закона химических элементов.
На основании закона Авогадро определяют молярные массы газообразных веществ. Чем больше масса молекул газа, тем больше масса одного и того же объема газа. В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул, а следовательно, и молей газов. Отношение масс равных объемов газов равно отношению их молярных масс:
m1:m2 = M1:M2,
где m1 — масса определенного объема первого газа; m2 — масса такого же объема второго газа; M1и М2 — молярные массы первого и второго газов.

M1/M2=D, отсюда М1=DM2.
2
Обычно плотность газа определяют по отношению к самому легкому газу — водороду (обозначают DH2). Молярная масса водорода равна 2,016 г/моль или приблизительно 2 г/моль. Поэтому получаем:
М=2DH2.

Часто плотность газа определяют по отношению к воздуху (Dв). Хотя воздух является смесью газов, все же говорят о его средней молярной массе. Она равна 29 г/моль. Среднюю молярную массу воздуха легко вычислить, если учесть, что воздух состоит приблизительно из 4 объемов азота (молярная масса 28 г/моль) и 1 объема кислорода (молярная масса 32 г/моль), т.е. 4N2+O2. Тогда:
(4•28+1•32).(4+1)=28,8 г/моль (округленно 29 г/моль).
В этом случае молярная масса определяется выражением:
М=29Dв.
Определение молярных масс показало, что молекулы простых газов состоят из двух атомов (Н2, F2, Сl2,O2, N2), а молекулы благородных газов — из одного атома (Не, Ne, Ar, Kr, Xe, Rn). Для благородных газов понятия «молекула» и «атом» равнозначны. Однако молекулы некоторых других простых веществ состоят из трех и более атомов, например молекулы озона О3, фосфора Р4, паров серы при высоких температурах S8.
На основании закона Авогадро осуществляют различные расчеты — вычисление объема, массы, плотности газов при нормальных условиях, молярной массы газообразных веществ, а также относительной плотности газов.
Жидкости
Жидкое состояние является промежуточным между газообразным и кристаллическим (см. §8.2). По одним свойствам жидкости близки к газам, а по другим — к твердым телам. С газами жидкости сближает прежде всего их изотропность и текучесть; последнее обусловливает способность жидкости легко изменять внешнюю форму. Однако высокая плотность и малая сжимаемость жидкостей приближает их к твердым телам.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жестких сил межмолекулярного взаимодействия. В то же время малая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объем, указывает на присутствие хотя и не жестких, но все же значительных сил взаимодействия между частицами.
Для каждого агрегатного состояния характерно свое отношение между потенциальной и кинетической энергиями частиц вещества. У твердых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твердых телах частицы занимают определенное положение друг относительно друга и лишь колеблются около этих положений. Для газов соотношение энергий обратное, вследствие чего молекулы газа всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объем. В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы, т.е. частицы связаны друг с другом, но не жестко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объем.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок — число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всем объеме данной жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры. При низких температурах, незначительно превышающих температуру плавления данного вещества, степень: упорядоченности расположения частиц данной жидкости велика. С ростом температуры она падает, и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа. При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствие сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твердым телам относятся только вещества в кристаллическом состоянии. Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах, в отличие от обычных жидкостей, частицы имеют незначительную подвижность — такую же, как в кристаллах.
8.7. Твердые тела. Основные типы кристаллических решеток: кубические и гексагональные
В твердом состоянии большинство веществ имеет кристаллическое строение. В этом легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствие различного отражения ими света. В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Каждое вещество обычно образует кристаллы определенной формы. Например, хлорид натрия кристаллизуется в форе кубов, квасцы в форме октаэдров, нитрат натрия в форме призм и т.д. Кристаллическая форма — одно из характерных свойств твердых веществ.
Классификация кристаллических форм основана на симметрии кристаллов. Различные случаи симметрии кристаллических многогранников подробно разбираются в курсах кристаллографии.
Многие вещества, в частности железо, медь, алмаз, хлорид натрия, кристаллизуются в кубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр. Магний, цинк, лед, кварц кристаллизуются в гексагональной системе. Основная форма этой системы — шестигранная призма и бипирамида.
Дата добавления: 2016-01-03; просмотров: 961;
