Температуры и давления
Агрегатные состояния вещества и переходы между ними в зависимости от
температуры и давления
Веществом называется совокупность большого количества частиц (атомов, молекул, ионов). Вещество может существовать и иметь определенное строение только за счет тех или иных взаимодействий между составляющими его частицами. При этом структура вещества, его физические свойства очень сильно зависят от энергии этих взаимодействий и ее соотношения с тепловой энергией движения частиц.
Для большинства веществ существуют четыре ясно отличающихся друг от друга состояния, переход между которыми осуществляется при изменении температуры. Эти состояния называются агрегатными: твердое, жидкое, газообразное, плазменное.
Для каждого вещества существует температура, при которой энергия связи между его частицами превышает энергию их тепловых колебаний. При этом колебательное движение, конечно, не прекращается, но его недостаточно для разрыва связей между частицами. При этом частицы обычно образуют правильную геометрическую структуру. Это состояние вещества называется твердым.
При повышении температуры наступает момент, когда энергия тепловых колебаний превышает энергию связей между частицами и они начинают поступательное движение. Геометрическая структура разрушается. Однако пока энергия поступательного движения не настолько велика, чтобы частицы могли окончательно оторваться друг от друга: они двигаются, сохраняя между собой постоянное расстояние. Такое состояние вещества называется жидким.
При дальнейшем повышении температуры энергия поступательного теплового движения превышает энергию взаимодействий между частицами, и они могут оторваться друг от друга.
Поскольку с увеличением расстояния сила взаимодействия падает, частицы располагаются на таком расстоянии друг от друга, какое возможно при их концентрации. Это состояние называется газообразным.
При сверхвысоких температурах либо в электрическом поле очень высокого напряжения возникает четвертое состояние — плазма. Строго говоря, это уже другое вещество, поскольку характеризуется наличием большого количества ионизированных молекул и свободных электронов.
Диаграммы состояния
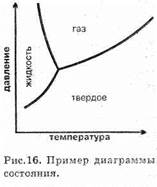
Переход вещества из одного агрегатного состояния в другое определяется не только температурой, но и давлением. Особенно сильна последняя зависимость для перехода жидкость — газ. При низких температурах и высоких давлениях вещество находится в твердом состоянии, при понижении температуры и давления переходит в жидкое и газообразное. При этом для каждого индивидуального вещества эти переходы имеют строгие количественные характеристики, которые наглядно отображаются так называемой фазовой диаграммой состояния. Это двумерная диаграмма, на осях которой отложены значения температуры и давления, а сама диаграмма в простейшем случае представляет собой три линии, сходящиеся в одной точке. Эти линии разделяют собой те области температуры и давления, которые соответствуют жидкому, твердому и газообразному состояниям (рис. 16).
Подробно о диаграмме состояния и ее свойствах рассказывается в курсе физики.
Дата добавления: 2016-01-03; просмотров: 1084;
