Оксиды марганца (II) и (IV). Гидроксид и соли марганца (II)
Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О
MnO — типичный основной оксид, с водой в реакцию не вступает. Ему соответствует гидроксид марганца (II), Mn(ОН)3, представляющий собой слабое основание. В виде осадка телесного цвета выпадает при взаимодействии щелочей с солями марганца (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Соли марганца (II), как правило, хорошо растворимы в воде, кроме Mn3(PO4)2, MnS, MnCO3.
Сульфат марганца (II) MnSO4 — соль белого цвета, одно из наиболее устойчивых соединений марганца (II). В виде кристаллогидрата MnSO4•7Н2O встречается в природе. Он используется при крашении тканей, а также наряду с хлоридом марганца (II) MnСl2 — для получения других соединений марганца.
Карбонат марганца (II) MnСO3 встречается в природе в виде марганцевого пшата и используется в металлургии.
Нитрат марганца (II) Mn(NO3)2 получают только искусственным путем и используют для разделения редкоземельных металлов.
В окислительно-восстановительных реакциях соединения марганца (II) — хорошие восстановители:
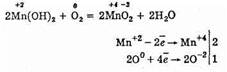
3Mn+2SO4+2КСl+5O3+12КОН=3К2Mn+6О4+2КСl-1+3K2SO4+6Н2О (эта реакция идет при сплавлении)
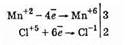
2Mn+2SO4+5Pb+4O2+ 6HNO3=2HMn+7O4+3Pb+2(NO3)2+2Pb+2SO4+2H2O
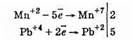
Оксид марганца (IV) MnO2 встречается в природе в виде минерала пиролюзита, который является важнейшей марганцевой рудой. Оксид марганца (IV) темно-бурого цвета, при хранении устойчив, обладает амфотерными свойствами, с преобладанием кислотных свойств:
MnO2+2KOH=K2MnO3+Н2О (реакция идет при сплавлении)
А в окислительно-восстановительных процессах в зависимости от условий может вести себя либо как окислитель, либо как восстановитель.
Например, одним из способов получения хлора служит окисление концентрированной соляной кислотой HСl оксида марганца (IV) по уравнению:
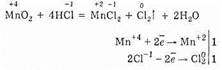
В реакции (идет при сплавлении) MnO2 является восстановителем:
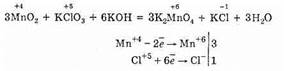
Оксид марганца (IV) служит катализатором в реакциях, протекающих с отщеплением кислорода, таких, как разложение бертолетовой соли или пероксида водорода:
2КСlO3=MnO2 2КСl+3O2
2Н2O2=MnO22Н2O+O2
Оксид марганца (IV) применяют в производстве стекла и в металлургии.
Гидроксид марганца (IV) неустойчив, его формула может быть представлена в двух видах: Mn(ОН)4 и Н4MnO4 ортомарганцоватистая и Н2MnO3 метамарганцоватистая кислота. Также, как и оксид марганца (IV), гидроксид марганца (IV) амфотерен.
Существует два типа солей четырехвалентного марганца. Это хлорид, сульфат марганца (IV) (MnСl4, Mn(SO4)2). Они неустойчивы.
Манганиты — соли мета- и ортомарганцоватистой кислоты. Так, закись-окись Mn3O4 (минерал гаусманит) можно рассматривать
+2 +4 -2
как соль Mn2MnO4, то есть манганит двухвалентного марганца.
Дата добавления: 2016-01-03; просмотров: 6956;
