Манганат и перманганат калия
Из соединений марганца (VI) наиболее характерны марганцоватая кислота Н2MnO4 и ее соли манганаты. И кислота, и ее соли
малоустойчивы. Например, зеленый раствор манганата калия по-
степенно становится фиолетовым вследствие превращения его в перманганат; одновременно выпадает гидрат двуокиси марганца:
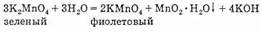
Вследствие перемены окраски раствора манганат калия в XVIII веке назвали минеральным хамелеоном (анион MnO2-4 придает раствору темно-зеленую окраску).
Манганат калия может проявлять свойства как окислителей, что более характерно (реакция 1), так и восстановителей (реакция 2):
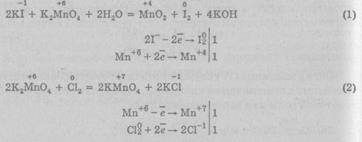
Из соединений семивалентного марганца первым рассматривают оксид марганца (VII) Mn2O7, известный под названием марганцевого ангидрида. Это зеленая маслянистая жидкость. В свободном состоянии его можно получить действием на перманганат калия концентрированной серной кислоты:
2KMnO4+H2SO4=K2SO4+Mn2O7+Н2О
При обычной температуре и в неподвижном состоянии это соединение сравнительно устойчиво, а при встряхивании или при нагревании выше 55°С разлагается с сильным взрывом:
2Mn2O7=4MnO2+3O2
При взаимодействии с водой образует сильную марганцовую кислоту:
Mn2О7+Н2O=2НMnO4
Mn2O7 — один из сильнейших окислителей. Горючие вещества при малейшем контакте с Mn2O7 воспламеняются: 2Mn2O7+С2Н5ОН=4MnO2+2СO2+3Н2О
Марганцовая кислота НMnO4 известна только в растворе, она довольно сильная кислота. Анион MnO-4 придает раствору малиново-фиолетовый цвет. Так же как и Mn2O7, марганцовая кислота обладает ярко выраженными окислительными свойствами.
Соли марганцовой кислоты носят название перманганатов. Наиболее важным среди них является перманганат калия KMnO4.
Перманганат калия — кристаллическое вещество, растворимое в воде, его раствор имеет фиолетовый цвет, в быту называется «марганцовкой». Он широко применяется в аналитических определениях и в лабораторной практике. В промышленности KMnO4 используется для отбеливания некоторых волокон, для обработки древесины, для промывания газов, а также в медицине как дезинфицирующее средство. Как и все соединения марганца (VII), является сильным окислителем. В зависимости от среды раствора (кислая, нейтральная или щелочная) Mn+7 восстанавливается до разных степеней окисления. В кислой среде продуктом восстановления перманганата являются соли марганца (II) Mn2+, в нейтральной среде, как правило, получается двуокись марганца MnО2, а в щелочной — соли марганцоватой кислоты Н2MnO4:
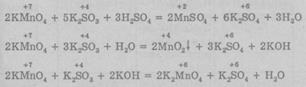
При нагревании перманганаты разлагаются с выделением кислорода и поэтому иногда применяются в лабораториях для его получения:
2KMnO4=K2MnO4+MnO2+O2
Изучая свойства соединений марганца (см. табл. 32), которые весьма разнообразны в зависимости от степени окисления последнего, можно заметить, что многие типичные для них реакции являются окислительно-восстановительными. Их поведение в окислительно-восстановительных реакциях подчиняется определенным правилам. Следует помнить, что:
1) Mn° и Mn+2 в окислительно-восстановительных реакциях ведут себя как восстановители;
2) Mn+7, наоборот, проявляет только окислительные свойства. Это нетрудно объяснить: Mn+7 полностью лишен валентных электронов и может только принимать их;
3) находясь в промежуточных степенях окисления, марганец может вести себя по-разному, т.е. проявлять как окислительные, так и восстановительные свойства в зависимости от того, с каким веществом он реагирует;
4) конечные продукты превращений марганца зависят от среды, I; в которой происходит реакция.
Таблица 32.
Дата добавления: 2016-01-03; просмотров: 6132;
