Вплив сольового ефекту на розчинність малорозчинного електроліту
Сольовим ефектом називається підвищення розчинності солей в системі «осад-розчин» при додаванні до системи інших сильних електролітів.
Сольовий ефект не можна пояснити тільки з точки зору поняття про добуток розчинності. Проте цей ефект можна пояснити виходячи з уявлень про активність йонів і йонну силу розчину. При додаванні до насиченого розчину малорозчинного електроліту розчину іншого сильного електроліту, що не має з малорозчинним електролітом однойменних йонів, йонна сила розчину підвищується, оскільки вона визначається концентраціями і зарядами всіх присутніх у розчині йонів:
μ = ½([Kt1]∙I2(Kt1)+[An1]∙I2(An1)+[Kt2]∙I2(Kt2)+[An2] I2(An2)+
+…[Ktn]∙I2(Ktn)+ [Ann]∙I2(Ann))
Так як величина йонної сили розчину залежить не тільки від концентрацій йонів, а також і від величини їх зарядів, то різні електроліти, додані в однакових кількостях, будуть створювати різний сольовий ефект.
Виходячи з йонної сили розчину, визначають коефіцієнти активностей йонів малорозчинного електроліту. Активність йона пропорційна його фактичній концентрації:
а = f ∙ c ,
де а – активність йона;
f – коефіцієнт активності цього йона;
с – концентрація даного йона в розчині в моль/дм3.
Осадження малорозчинних сполук спільним реагентом відбувається ступінчасто. Спочатку осаджується найбільш малорозчинна сполука, добуток розчинності якої досягається при найменшій концентрації осаджуючого реагента, а потім осаджуються інші сполуки у порядку збільшення їх добутків розчинності або підвищення концентрації осаджуючого реагента.
Коли осаджувані речовини мають дуже близькі значення добутків розчинності, порядок їх осадження буде залежати не тільки від величини їх добутків розчинності, а також і від вихідних концентрацій цих йонів у розчині.
Добудок розчинності дозволяє за концентраціями реагуючих речовин розраховувати можливість утворення і розчинення осадів при перебігу реакцій обміну, а також розраховувати повноту осадження досліджуваних йонів.
В якісному аналізі часто буває необхідно перетворювати одні малорозчинні сполуки в інші. Такі процеси перетворень цілком зрозумілі виходячи з поняття про добуток розчинності малорозчинного електроліту. Так, наприклад, практичне значення має розчинення малорозчинних осадів, зокрема сульфатів Барію, Стронцію, Кальцію. Ці сульфати нерозчинні ні в кислотах, ні в лугах. Щоб їх розчинити, спочатку перетворюють сульфати в карбонати дією концентрованого розчину натрій карбонату при нагріванні При цьому відбувається наступна реакція, наприклад:
CaSO4↓ + Na2CO3 D CaCO3↓ + Na2SO4
Ця реакція йде легко і практично до кінця зліва праворуч, так як ДР(CaCO3)=4,8∙10-9, що майже в 5000 разів менше ДР(CaSO4)=2,37∙10-5.
Якщо порівняти величину ДР(BaSO4)=1,1∙10-10 та ДР(BaCO3)=5,1∙10-9, то здається, що перетворити барій сульфат у барій карбонат неможливо. Дійсно, реакція:
BaSO4↓ + Na2CO3 D BaCO3↓ + Na2SO4
сама по собі не йде. Але якщо врахувати закон діючих мас і діяти на осад барій сульфату великим надлишком натрій карбонату, то можна змістити рівновагу реакції праворуч і отримати осад барій карбонату.
Осад барій карбонату утворюється тоді, коли добуток розчинності його виявляється перевищеним, тобто:
[Ba2+]∙[CO32–] > ДР(BaCO3)
У цій нерівності концентрація Ba2+-йонів визначається розчинністю BaSO4 і дорівнює:
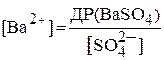
Отже, можна тільки збільшувати концентрацію карбонат-іонів і добиватися, щоб відношення
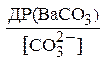
стало менше відношення
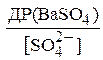
тобто, щоб
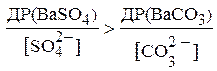
Перетворивши отриману нерівність, можна записати:
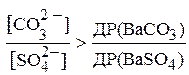
Підставивши у цю нерівність числові значення добутків розчинності BaSO4 та BaCO3, отримуємо:
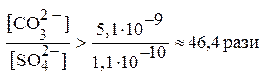
Отже, для того, щоб перетворити BaSO4 в BaCO3 необхідно, щоб концентрація CO32--іонів у розчині за рахунок Na2CO3 була в 46,4 рази вищою, ніж рівноважна концентрація SO42--іонів у насиченому розчині BaSO4.
Дата добавления: 2015-12-26; просмотров: 2619;
