Частина I Теоретичні основи аналітичної хімії
Розділ 1 Закон діючих мас та його застосування в аналітичній хімії
Закон діючих мас
Закон діючих мас є основним законом хімічної рівноваги. Його відкрили у 1864-67рр. норвезькі фізико-хімік і математик К.М. Гульдберг і фізико-хімік П. Вааге.
Цей закон має таке формулювання:
Швидкість хімічної реакції пропорційна добутку молярних концентрацій реагуючих речовин.
Закон справедливий тільки для рівноважних систем. Його можна сформулювати ще так:
У стані рівноваги відношення добутку концентрацій (точніше активностей) продуктів реакції до добутку концентрацій (активностей) реагуючих речовин є величина стала.
Хоча рівновага визначається не масами речовин, що беруть участь у реакції, а їх концентраціями, а ще точніше – активностями речовин у розчині, закон зберіг історичну назву.
Для реакції mA+nB D pC+qD швидкість прямої реакції V1=K1·сm(A)·сn(B), а швидкість зворотної реакції V2=K2·сp(C)·сq(D). За умов хімічної рівноваги V1=V2. Тоді K1·сm(A)·сn(B)=K2·сp(C)·сq(D). K1 і K2 – константи швидкостей прямої і зворотної реакцій.
Константа швидкості реакції – швидкість реакції при концентраціях реагуючих речовин по 1моль/дм3.
Відношення константи швидкості прямої реакції до константи швидкості зворотної реакції є константа рівноваги хімічної реакції:
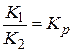 ;
;
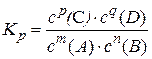 ;
;
Отже, константа рівноваги хімічної реакції є відношення добутку молярних концентрацій продуктів реакції до добутку молярних концентрацій вихідних речовин у степенях, що відповідають стехіометричним коефіцієнтам у рівнянні реакції.
Константа хімічної рівноваги є характерною для кожної хімічної реакції величиною, яка не залежить від концентрацій реагуючих речовин.
Константу рівноваги можна виразити більш точно, якщо замість концентрацій с у рівняння ввести величину а – активність компонентів рівноважної системи. Це необхідно для того, щоб наблизити реальний розчин до ідеального, який описується законом Рауля і іншими законами, що випливають із закону Рауля. Ідеальними називаються такі розчини, коли розчинення відбувається без зміни об’єму, тоді теплота розчинення дорівнює нулю.
Для розведених розчинів відхилення від закону Рауля настільки незначне, що ним можна знехтувати. Величина а відповідає законам ідеальних розчинів і зв’язана з концентрацією співвідношенням:
a=f·с, де f – коефіцієнт активності.
Числові значення а і коефіцієнтів активності f залежать від одиниць, в яких виражена концентрація с.
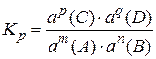 ;
;
Якщо концентрація виражена в моль/дм3, то константа рівноваги позначається Kс.
Рівноважні концентрації, отже і константа K, змінюється з температурою, тому завжди необхідно вказувати температуру, при якій вимірювались рівноважні концентрації.
Закон діючих мас встановлює взаємозв’язок між концентраціями (активностями) реагуючих речовин і продуктів реакції при досягненні стану рівноваги. Незалежно від кількості вихідних речовин, а також від того, чи були присутні продукти реакції у вихідній реакційній суміші, рівноважні концентрації взаємозв’язані таким чином, що вираження константи рівноваги завжди виконується. Якщо відомі константа рівноваги будь-якої реакції при певній температурі і початкові концентрації компонентів системи, то можна розрахувати концентрації всіх компонентів системи, яка знаходиться у стані рівноваги при даній температурі.
Константа хімічної рівноваги є відношення констант швидкостей прямої і зворотної реакцій і показує, у скільки разів пряма реакція йде швидше зворотної за даних умов і за даного добутку концентрацій реагуючих речовин, що дорівнює одиниці. Якщо Kр>1, то швидше йде пряма реакція, якщо Kр<1, то швидше йде зворотна реакція.
Дата добавления: 2015-12-26; просмотров: 801;
