Застосування закону діючих мас до рівноважних систем “розчин-осад”. Добуток розчинності
Добуток концентрацій (активностей) йонів малорозчинного електроліту у його насиченому розчині при сталій температурі є величина стала і називається добутком розчинності (ДР).
BaSO4 D Ba2++  ;
;
а(Ba2+)∙a(  ) = ДР(BaSO4) = 1,08∙10–10.
) = ДР(BaSO4) = 1,08∙10–10.
Якщо якийсь малорозчинний електроліт дисоціює з утворенням двох чи декількох однакових йонів, наприклад:
КtmАnn D mKta+ + nАnв–,
де m і n – відповідно число катіонів і аніонів, утворених з однієї частинки електроліту; а+ і в– — заряди катіона і аніона, то
ДР(КtmАnn) = 
Тобто, при розрахунках добутку розчинності активність кожного з йонів повинна бути піднесена до степеня, що дорівнює числу однакових йонів, що утворилися при розпаді однієї частинки.
Слід зазначити, що концентрація твердої фази у стані рівноваги „розчин-осад” приймається за одиницю.
До рівноваги між йонами в розчині і осадом малорозчинного електроліту можна застосувати закон діючих мас. Наприклад:
AgCl D Ag++Cl–;
Константа рівноваги 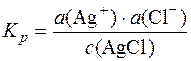 ;
;
Kр∙с(AgCl) = ДР = а(Ag+)∙а(Cl–).
У випадку, коли коефіцієнт активності йонів наближається до одиниці у дуже розведеному розчині, можна вважати, що
ДР(AgCl) = с(Ag+)∙с(Cl–).
Як би не змінювалась концентрація йонів, з яких утворюється малорозчинний електроліт, добуток молярних концентрацій цих йонів при Т=const є величина стала для насиченого розчину даної малорозчинної речовини.
Слід розрізняти поняття „малорозчинна” і „слабкодисоційована” речовина. Речовина може бути малорозчинною, але сильним електролітом, тобто осад є йонною сполукою. З іншого боку, добре розчинна речовина може бути слабким електролітом.
Для того, щоб відбулося осадження малорозчинного електроліту, необхідно, щоб добуток молярних концентрацій йона, який осаджується, і йона-осаджувача був більшим ніж добуток розчинності малорозчинного електроліту, що утворюється, тобто речовина починає випадати в осад з пересиченого при даній температурі розчину; йона-осаджувача повинен бути надлишок. Однак при додаванні великого надлишку реактива-осаджувача може відбутися часткове чи повне розчинення утвореного осаду в результаті комплексоутворення, амфотерності, утворення колоїдних систем та ін.
Дата добавления: 2015-12-26; просмотров: 1192;
