Розчинність малорозчинного осаду сильного електроліту за рахунок пептизації
Утворений осад малорозчинного електроліту при додаванні надлишку осаджувача може розчинятися в результаті утворення колоїдної системи. Розглянемо це явище на прикладі розчинення осаду AgI при додаванні до системи «осад-розчин» надлишку йодиду. Арґентум йодид утворюється при взаємодії арґентум нітрату з калій йодидом:
AgNO3 + KI = AgI↓ + KNO3
Якщо до розчину KI додавати краплинами розчин AgNO3, то на поверхні ядра колоїдної частинки, що складається з m молекул AgI, будуть адсорбуватися вибірково тільки йодид-іони, яких в даний момент у розчині надлишок, і частинка набуде від’ємного заряду. Колоїдна частинка є не просто дисперсною частинкою у вигляді полімолекулярного агрегату колоїдних розмірів з деякими фізичними властивостями (кінетичною рухливістю, електричним зарядом і ін.), а являє собою складне новоутворення, у якому речовина дисперсної фази (ядро частинки) знаходиться в певному фізико-хімічному зв’язку з навколишнім середовищем через стабілізуючий подвійний електричний шар йонів і через щільну сольватну оболонку з молекул розчинника. Таке новоутворення називається міцелою. Як найменша кількість колоїдної речовини, міцела здатна існувати самостійно у вигляді відокремленої частинки та визначає всі основні властивості колоїдної системи.
До складу міцели входять:
– ядро кристалічної структури чи аморфної будови;
– подвійний електричний шар із сольватованих йонів;
– дифузна частина подвійного шару з протиіонів.
Розглянемо схему будови міцели золя арґентум йодиду, утвореної за умови надлишку йодид-іонів у розчині та розподілення потенціалів у подвійному електричному шарі:
{m [AgI] nI-(n-x)K+}х- xK+
Умовні позначення:
m – число молекул в ядрі частинки (ядро заключено в квадратні дужки);
n – число йонів, міцно адсорбованих на поверхні ядра. Вони називаються потенціалвизначальними;
x – число протиіонів, що утворюють зовнішній, так званий дифузний шар йонів;
(n-x) – частина протиіонів, що входять в адсорбційний шар і до складу частинки (частинка заключена у фігурні дужки).
У безпосередній близькості до поверхні ядра, від’ємно зарядженої потенціалвизначальними адсорбованими йонами nI-, на відстані, що дорівнює середньоу йонному радіусу, розташований перший шар протиіонів (n-x)K+. Ці йони входять до складу адсорбційного шару і в звичайних умовах вони нерухомі, а переміщуються разом з ядром частинки. Далі від адсорбційного шару йонів – у навколишньому розчині – дифузно розподілений залишок загального заряду у вигляді безперервного об’ємного заряду, що знижується асимптотично до нуля в міру віддалення від стінки в глибину розчину. Це дифузна частина шару із йонів, що залишились, – xK+. Товщина дифузної частини подвійного шару, в залежності від концентрації електроліту, може змінюватись у широких межах.
Колоїдні частинки мають дуже малі розміри. Їх діаметри знаходяться в межах 1-150 нм, але більші за молекули розчинника. Оскільки діаметри колоїдних частинок менші від довжини хвиль світла видимої області спектра, то світло від таких частинок не відбивається, а лише має місце дифракція світлових променів. Тому колоїдні частинки невидимі навіть у потужні світлові мікроскопи.
Процес переходу речовини із стану осаду в колоїдний стан під впливом введених у систему «осад-розчин» розчинів сильних електролітів називається пептизацією. На швидкість розчинення малорозчинних осадів за рахунок пептизації впливають концентрація і хімічні властивості електроліту, що викликає пептизацію, кількість і стан осаду, температура, перемішування і ін.
З пептизацією мають справу в практиці хімічного аналізу при інтенсивному промиванні осадів.
Гідроліз солей
Реакції нейтралізації – взаємодія кислот з основами з утворенням солей і води.
Реакції нейтралізації бувають незворотні і зворотні.
Оскільки солі у водних розчинах знаходяться у вигляді йонів, що перебувають у русі і контактують з молекулами і йонами води, то для випадків зворотних реакцій нейтралізації взаємодія йонів солі з йонами води називається гідролізом солей.
Реакції нейтралізації між сильними кислотами і сильними основами є незворотними і можуть бути представлені одним рівнянням реакції:
Н+ + ОН– = Н2О.
Наприклад:
NaOH + HCl = NaCl + H2O;
Na+ + ОН– + Н+ + Cl– = Na+ + Cl– + H2O;
Н+ + ОН– = H2O.
Взаємодії води з йонами Na+ і Cl– з утворенням вихідних речовин відбуватися не може. Реакції завжди йдуть у бік утворення малодисоційованої речовини.
Реакції нейтралізації між сильною кислотою і слабкою основою є зворотними:
HCl + NH4OH D NH4Cl + H2O;
H+ + Cl– + NH4OH D NH4+ + Cl– + H2O;
H+ + NH4OH D NH4+ + H2O.
У даному випадку відбувається гідроліз солі NH4Cl за катіоном 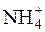 .
.
Реакції нейтралізації між сильною основою і слабкою кислотою теж є зворотними:
NaOH + CH3COOH D CH3COONa + H2O;
Na+ + OH– + CH3COOH D CH3COO– + Na+ + H2O;
OH– + CH3COOH D CH3COO– + H2O.
У цьому випадку відбувається гідроліз солі СН3СООNa за аніоном СН3СОО–.
Зворотними є і реакції нейтралізації між слабкою кислотою і слабкою основою:
CH3COOH + NH4OH D CH3COONH4+H2O;
CH3COOH + NH4OH D CH3COO– + NH4+ + H2O.
Відбувається гідроліз солі CH3COONH4 і за катіоном NH4+, і за аніоном CH3COO–.
До реакцій гідролізу солей можна застосувати закон діючих мас.
Для реакції: CH3COO– + H2O D CH3COOH + OH– константа рівноваги
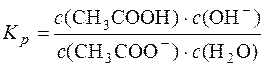 .
.
Концентрація води с(H2O) практично постійна.
Kр∙с(H2O) = Kг (константа гідролізу).
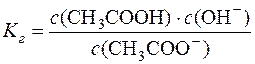 .
.
Дисоціація СН3СООН:
СН3СООН D СН3СОО– + Н+.
Константа дисоціації кислоти 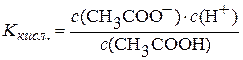 .
.
Підставимо значення 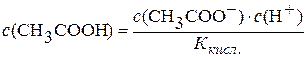 у рівняння константи гідролізу:
у рівняння константи гідролізу:


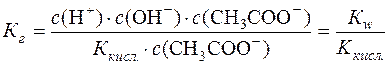 .
.
Таким чином, константа гідролізу гідролітично лужної солі дорівнює відношенню йонного добутку води до константи дисоціації слабкої кислоти, утвореної в результаті гідролізу аніона солі.
Виходячи з наведеного:
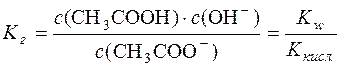 .
.
Оскільки при гідролізі СН3СОО– утворюється рівна кількість молекул СН3СООН і йонів OH–, тобто с(СН3СООН) = с(OH–), рівняння константи гідролізу можна переписати так:
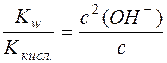 ,
,
де с – аналітична концентрація солі.
З рівняння йонного добутку води Kw = c(H+)∙c(OH–) можна записати:
 .
.
Підставляючи цей вираз у рівняння  маємо:
маємо:
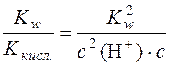 ;
; 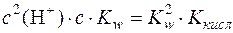 ;
;
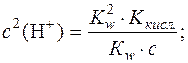
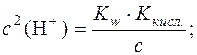
 .
.
Логарифмуючи цей вираз і змінюючи знаки на протилежні, отримаємо рівняння для розрахунку pH розчину гідролітично лужної солі:
 .
.
Враховуючи, що Kw=1∙10-14 і –lgKкисл.=рК, отримуємо:
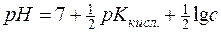 ; с – аналітична концентрація солі (моль/дм3).
; с – аналітична концентрація солі (моль/дм3).
Ступінь гідролізу h солі є відношення кількості солі, яка вступила в реакцію гідролізу до всієї кількості розчиненої солі.
У момент рівноваги с(ОН–)=с(СН3СООН)=с·h, а с(СН3СОО–)=с–ch – загальній концентрації солі, так як солі даного типу гідролізуються відносно мало, тобто с»с∙h.
Підставляючи ці концентрації у формулу  , отримуємо:
, отримуємо:
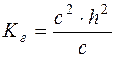 ;
; 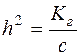 ;
; 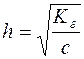 .
.
Враховуючи, що  ,
,  .
.
Для реакції 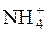 + H2O D NH4OH + H+ константа рівноваги
+ H2O D NH4OH + H+ константа рівноваги
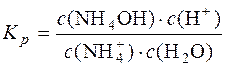 ;
;
Kр·с(Н2О) = Kг;
Kг = 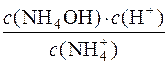 .
.
Дисоціація NH4OH:
NH4OH D 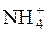 + ОН–.
+ ОН–.
Константа дисоціації NH4OH:
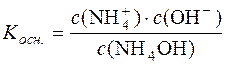 .
.
Звідси: 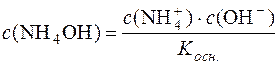 .
.
 Підставимо значення с(NH4OH) у рівняння константи гідролізу:
Підставимо значення с(NH4OH) у рівняння константи гідролізу:

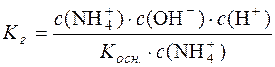 ;
; 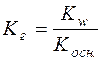 .
.
Отже, константа гідролізу гідролітично кислої солі є відношення йонного добутку води до константи дисоціації слабкої основи, яка утворюється в результаті гідролізу катіона солі.
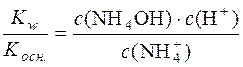 .
.
У стані рівноваги с(NH4OH) = с(H+). Тоді можна записати:
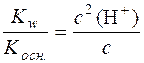 ,
,
де с – аналітична концентрація солі.
З цієї формули с2(Н+)·Kосн. = Kw·ссолі; с2(Н+) = 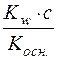 ;
;
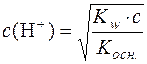 .
.
Логарифмуючи останній вираз і змінюючи знаки на протилежні, отримаємо:
–lgc(H+) = –½lgKw – ½lgcсолі + ½lgKосн.
Kw = 1·10–14, –lgKосн. = рKосн.
pH = 7 – ½рKосн. – ½lgcсолі
У момент рівноваги с(NH4OH) = с(H+) = с·h
Тоді рівняння константи гідролізу можна записати:
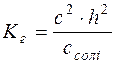 ; Kг=h2·c;
; Kг=h2·c; 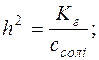
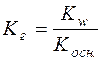 ;
; 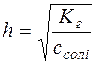 ;
; 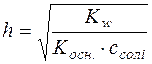 .
.
Для реакції гідролізу солі, що гідролізується і за катіоном, і за аніоном,
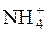 + СН3СОО– + Н2О D NH4OH + СН3СООН;
+ СН3СОО– + Н2О D NH4OH + СН3СООН;
константа рівноваги:
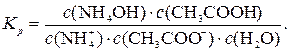
Концентрація води с(Н2О) є сталою. Тоді можна записати:
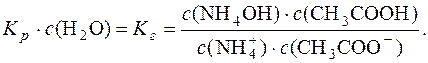
Дисоціація NH4OH: NH4OH D 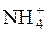 + ОН–. Константа дисоціації основи:
+ ОН–. Константа дисоціації основи:
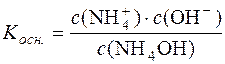 .
.
Звідси:
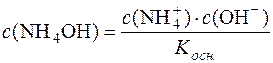 .
.
Дисоціація СН3СООН: СН3СООН D СН3СОО– + Н+.
Константа дисоціації кислоти:  .
.
Звідси: 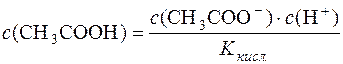 .
.
Підставимо значення с(NH4OH) і с(СН3СООН) у момент рівноваги у формулу константи гідролізу:



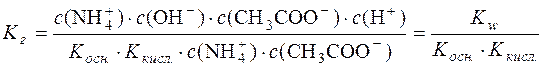 ;
;
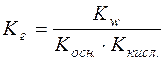 .
.
У момент рівноваги с(NH4OH) = с(СН3СООН) = с·h.
с( 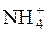 ) = с–с·h; с(СН3СОО–) = с–с·h.
) = с–с·h; с(СН3СОО–) = с–с·h.
 ;
; 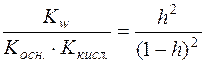 ;
; 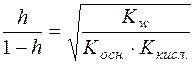 ;
;
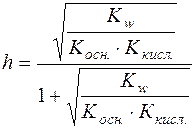 .
.
Отже, гідроліз солей – це взаємодія йонів солі з йонами води, що супроводжується порушенням рівноваги електролітичної дисоціації води і утворенням малодисоційованих продуктів, що призводить до накопичення йонів Н+ або ОН–, тобто до виникнення кислої чи лужної реакції розчину.
Значення гідролізу в якісному аналізі
Реакції гідролізу широко розповсюдженні при виконанні якісного аналізу. Вони використовуються як характерні реакції виявлення деяких катіонів і аніонів. Так, наприклад, розчинна сіль Bi(NO3)3, зазнаючи гідролізу, утворює важкорозчинні основні солі Bi(OH)(NO3)2, Bi(OH)2NO3. Реакцією гідролізу відкривають катіони Алюмінію, аніони SiO32–, CH3COO– та інші:
2Na2SiO3 + 3HOH + 4NH4Cl D H2Si2O5 + 4NaCl + 4NH4OH
У даному випадку має місце гідроліз силікат-аніона, в результаті чого утворюється метакремнієва кислота:
SiO32– + 2HOH D H2SiO3 + 2OH–
Гідролітичне розщеплення силікатів супроводжується утворенням колоїдів поліметакремнієвих кислот, зокрема діметакремнієвої кислоти H2Si2O5. Гідроліз натрій силікату гальмується тим, що середовище накопичує гідроксид-іони. Для підсилення гідролізу додають у розчин кислоту та амоній хлорид для зв’язування гідроксид-іонів:
2OH– + 2H+ D 2H2O
2NH4+ + 2OH– D 2NH4OH
При нагріванні гідроліз силікатів покращується. При цьому відбувається часткова дегідратація метакремнієвої кислоти:
2H2SiO3 → H2Si2O5 + H2O,
а амоній гідроксид при нагріванні (точніше NH3∙H2O) розщеплюється з видаленням з розчину амоніаку, що призводить до посилення процесу гідролізу силікату.
Реакції гідролізу використовуються і для розділення йонів. Так, для розділення йонів Al3+ та Cr3+ до досліджуваного розчину додають надлишок лугу:
Al3+ + 6OH– D [Al(OH)6]3–
Cr3+ + 6OH– D [Cr(OH)6]3– ; [Cr(OH)6]3– D CrO33– + 3H2O;
При кип’ятінні такої суміші [Cr(OH)6]3- гідролізується і в осад випадає Cr(OH)3 :
CrO33– + 3HOН → Cr(OH)3 + 3OH−
Реакції гідролізу використовуються і для регулювання рН досліджуваного середовища. Наприклад, для підвищення рН середовища до розчину додають сіль, яка гідролізується за аніоном, в результаті чого підвищується концентрація у розчині гідроксид-іонів:
CO32– + HOH D HCO3− + OH−,
а для зниження рН середовища до нього додають сіль, яка гідролізується за катіоном:
2NH4+ + HOH D NH4OH + H+
Інколи буває необхідно пригнічувати гідроліз солей, коли він заважає проведенню аналізу. Якщо сіль гідролізується за аніоном, то для пригнічення її гідролізу у розчин необхідно ввести луг і тоді, згідно із законом діючих мас, рівновага реакції гідролізу солі буде зміщена ліворуч, а коли сіль гідролізується за катіоном, то для пригнічення її гідролізу слід до розчину додати кислоту. Наприклад:
Fe2+ + 2HOH D Fe(OH)2 + 2H+
Для посилення гідролізу солей треба зв’язувати чи йони гідроксонію, чи гідроксид-іони в залежності від того, за яким йоном гідролізується сіль. Для зв’язування йонів гідроксонію чи гідроген-іонів можна застосувати не тільки розчини кислот чи основ, а також розчини солей сильних основ і слабких кислот, наприклад, Na2CO3, Na2HPO4, CH3COONa і ін. Ці солі зв’язують йони гідроксонію з утворенням гідрогенаніонів HCO3–, H2PO4– або нейтральних молекул слабких кислот:
CO32– + H+ → HCO3–
HCO3– + H+ → H2CO3 → H2O + CO2
Гідроксид-іони можна зв’язувати в комплексні йони, діючи солями слабких основ і сильних кислот, наприклад:
Al3+ + OH− → [Al(OH)]2+
[Al(OH)]2+ + OH– → [Al(OH)2]+
Ступінь гідролізу солей збільшується при нагріванні, так як при цьому збільшується швидкість прямої реакції гідролізу, а крім того, збільшується і константа дисоціації води. Ступінь гідролізу залежить від концентрації солі в розчині: чим менша концентрація солі, тим більший ступінь її гідролізу.
Буферні системи
Системи, здатні зберігати pH у деяких визначених вузьких межах при додаванні до них кислоти або лугу або при їх розведенні, називаються буферними.
Буферні системи складаються переважно з двох компонентів, кожен з яких відіграє певну роль у збереженні pH середовища приблизно на одному рівні. Здебільшого буферні системи складаються із суміші слабких кислот або слабких основ з їх солями. Наприклад:
§ СН3СООН+СН3СООNa;
§ Н2СО3+NaНСО3;
§ NH4ОН+NH4Cl;
§ NaН2РО4+ Na2НРО4;
§ НСООН+НСООNa;
§ цитрат+Na-цитрат;
§ цитрат+СН3СООNa;
§ НСООН+ NaОН;
§ Н3ВО3+ Na2В4О7.
Буферну дію можуть проявляти системи, до складу яких входять аніони різних слабких кислот, наприклад фосфат-цитратний буфер Na2НРО4+цитрат.
Суть буферної дії. Приклад ацетатного буфера.
СН3СООН D СН3СОО– + Н+;
СН3СООNa = СН3СОО– + Na+.
Оскільки дисоціація кислоти незначна, у розчині переважають недисоційовані молекули. Натрій ацетат є сильним електролітом, дисоціює повністю на йони. Наявність у розчині великої кількості йонів СН3СОО– із солі зміщує рівновагу дисоціації оцтової кислоти в бік утворення її молекул. Дисоціація оцтової кислоти може бути настільки пригнічена, що кислоту можна вважати практично недисоційованою. В результаті цього активність йонів Н+ дуже мала. Додавання кислоти чи лугу до ацетатної суміші не викликає суттєвої зміни концентрації йонів Н+ у розчині:
СН3СООNa + НСl " NaСl + СН3СООН;
СН3СОО– + Н+ " СН3СООН.
Сильна кислота в результаті цієї реакції заміщується еквівалентною кількістю слабкої кислоти. У відповідності із законом розведення Оствальда, збільшення концентрації оцтової кислоти знижує ступінь її дисоціації, в результаті чого концентрація йонів Н+ у буферному розчині збільшується від додавання сильної кислоти в незначній мірі.
У такій же незначній мірі змінюється pH буферного розчину при додаванні до нього невеликої кількості лугу:
СН3СООН + NaОН D Н2О + СН3СООNa;
СН3СООН + ОН– D Н2О + СН3СОО–.
У цьому випадку луг, що додається, заміщується еквівалентною кількістю гідролітично слабкоосновної солі, яка впливає на реакцію середовища в меншій мірі, ніж NaОН.
З іншого боку, зменшення концентрації йонів Н+ кислоти зміщує рівновагу дисоціації
СН3СООН D СН3СОО– + Н+
в бік розпаду на йони нових молекул кислоти і pH розчину при додаванні сильної основи збільшується в дуже незначній мірі.
Приклад амонійного буфера:
NH4ОН D 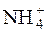 + ОН–;
+ ОН–;
NH4Cl = 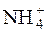 + Cl–.
+ Cl–.
Велика концентрація йонів 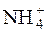 із солі, яка є сильним електролітом і існує у розчині у вигляді вільних йонів, зміщує рівновагу дисоціації NH4ОН вліво, пригнічуючи цю дисоціацію.
із солі, яка є сильним електролітом і існує у розчині у вигляді вільних йонів, зміщує рівновагу дисоціації NH4ОН вліво, пригнічуючи цю дисоціацію.
При додаванні до амонійного буферного розчину сильної кислоти
NH4ОН + НCl D NH4Cl + Н2О;
NH4ОН + Н+ D NH4+ + Н2О
сильна кислота заміщується гідролітично слабкокислотною сіллю, pH при цьому зменшується в незначній мірі. Крім того, зв’язування ОН– у Н2О призводить до зміщення рівноваги дисоціації NH4ОН праворуч.
При додаванні до амонійного буферного розчину невеликої кількості лугу:
NH4Cl + NaОН D NH4ОН + NаCl;
NH4++ ОН– D NH4ОН
сильна основа заміщується еквівалентною кількістю слабкодисоційованого NH4ОН, pH розчину при цьому зростає у незначній мірі.
Розрахунки pH буферних систем.
Приклад ацетатного буферного розчину.
СН3СООН D СН3СОО– + Н+.
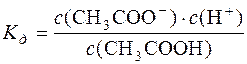 ;
; 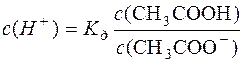 .
.
У присутності в розчині СН3СООNa велика концентрація йонів СН3СОО– із солі пригнічує дисоціацію оцтової кислоти, внаслідок чого концентрацію недисоційованих молекул кислоти можна прийняти за загальну концентрацію кислоти.
Враховуючи те, що сіль СН3СООNa є сильний електроліт і у водному розчині йонізована повністю, можна прийняти, що загальна концентрація СН3СОО– практично дорівнює аналітичній концентрації солі в даній буферній системі, тобто с(СН3СОО–) = с(солі). Відповідно концентрація недисоційованих молекул кислоти дорівнює загальній концентрації кислоти: с(СН3СООН) = с(кислоти). Тоді:
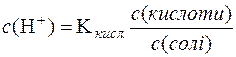 .
.
Логарифмуючи цей вираз, маємо:
lgc(H+) = lgKкисл. + lgc(кислоти) – lgc(солі)
Замінюємо знаки на протилежні:
–lgc(H+) = –lgKкисл. + lgc(солі) – lgc(кислоти);
–lgc(H+) = pH; –lgKкисл. = рKкисл.;
pH = рKкисл. – lgc(кислоти) + lgc(солі).
Аналогічно для буферного розчину NH4ОН + NH4Сl:
pH =14 – рKосн..+ lgc(основи) – lgc(солі).
Межа, в якій проявляється буферна дія, називається буферною ємністю.
Буферна ємність виражається кількістю речовини еквівалента сильної кислоти чи сильної основи, яку слід додати до 1м3 буферного розчину, щоб змістити pH на одиницю:
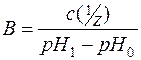 ,
,
де В – буферна ємність;
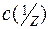 – молярна концентрація еквівалента сильної кислоти чи сильної основи, кмоль/м3;
– молярна концентрація еквівалента сильної кислоти чи сильної основи, кмоль/м3;
pH0 – до додавання розчину сильної кислоти чи сильної основи;
pH1 – після додавання розчину сильної кислоти чи лугу.
Для отримання буферних систем із заданим значенням pH необхідно взяти розчин слабких кислот чи основ з відповідними значеннями констант дисоціації, а також підібрати певні співвідношення компонентів. Оскільки константа електролітичної дисоціації К за даних умов стала, pH буферного розчину буде залежати тільки від співвідношення концентрацій кислоти ( або основи) і солі, взятих для приготування буферного розчину, і не залежить від абсолютних значень цих концентрацій. Тому при розведенні буферних розчинів pH змінюється у дуже незначній мірі, навіть при розведенні в 10-20 разів.
Величина буферної ємності залежить від концентрації компонентів буферної системи і співвідношення між цими концентраціями.
Дата добавления: 2015-12-26; просмотров: 1323;
