Расчет продуктов сгорания
Показатели горения рассчитывают по реакциям горения компонентов горючей смеси. Расчет ведут на 100 м3 сухого газа и все объемы относят к нормальным условиям. Результаты расчета сводят в таблицу 9.1.
Пример 9.1. Найти объемы воздуха, водяных паров, сухих продуктов сгорания, если задан объемный состав сухого газа в %:
СН4 = 98%; С2Н6 = 0,16; С3Н8 = 0,08; С4Н10 = 0,06; СО2 = 0,4; N2 = 1,3.
Влагосодержание воздуха dв = 10 г/м3 сухого воздуха; 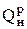 = 35080 кДж/м3; ρг = 0,73 кг/м3.
= 35080 кДж/м3; ρг = 0,73 кг/м3.
Решение:
1. Для расчета показателей горения газа составим таблицу 9.1. По второй графе таблицы записываем объемные количества компонентов, приходящиеся на 100 м3 газа. В третьей графе приводятся стехиометрические уравнения реакции горения.

 2. Продукты горения газа рассчитываем при теоретическом количестве воздуха V0 (α = 1,0), а затем определяем количество избыточного воздуха Vизб (α = 1,1).
2. Продукты горения газа рассчитываем при теоретическом количестве воздуха V0 (α = 1,0), а затем определяем количество избыточного воздуха Vизб (α = 1,1).
3. Рассчитываем расходы воздуха О2 и N2 (графы 4, 5):
при СН2 = 98 О2 = 98∙2 = 196;
при С2Н6 = 0,16 О2 = 0,16∙3,5 = 0,56 и т.д.
Учитывая, что соотношение между азотом и кислородом равно
N2/О2 = 79/21 = 3,76,
вычисляем для СН4: N2/196 = 3,76; N2 = 737;
Таблица 9.1
Расчет показателей горения
| Компо-ненты | Кол-во ком-та м3/100м3 газа | Уравнение реакций горения | Расход воздуха, м3 | Выход продуктов горения, м3 | ||||||
| О2 | N2 | Итого | СО2 | Н2О | N2 | О2 | Итого | |||
| СН4 | СН4+ 2О2 = СО2 + 2Н2О | - | - | |||||||
| С2Н6 | 0,16 | С2Н6 + 3,5О2 = 2СО2 + 3Н2О | 0,56 | 2,1 | - | 0,32 | 0,48 | 2,1 | - | |
| С3Н8 | 0,08 | С3Н8 + 5О2 = 3СО2 + 4Н2О | 0,4 | 1,5 | - | 0,24 | 0,32 | 1,5 | - | |
| С4Н10 | 0,06 | С4Н10 + 6,5О2 = 4СО2 + 5Н2О | 0,39 | 1,46 | - | 0,24 | 0,3 | 1,46 | - | |
| СО | - | СО + 0,502 = СО2 | - | - | - | - | - | - | - | |
| Н2 | - | Н2 + 0,5О2 = Н2О | - | - | - | - | - | - | - | |
| СО2 | 0,4 | - | - | - | 0,4 | - | - | - | ||
| N2 | 1,3 | - | - | - | - | - | - | - | ||
| О2 | - | - | - | - | - | - | - | |||
| Итого 100 | - | - | - | - | - | - | - | |||
| Влага газа | - | - | - | - | - | - | ||||
| Влага воздуха | - | - | - | - | 11,68 | - | - | - | ||
| Итого при теоретическом сгорании (α = 1,0) | 197,35 | 742,06 | 939,41 | 99,2 | 197,2 | 742,06 | 1038,46 | |||
| Количество избыточно го воздуха | 19,7 | 74,2 | 93,94 | - | - | 74,2 | 19,7 | - | ||
| Дополнительное количество влаги с избыточным воздухом | - | - | - | 1,17 | - | - | - | |||
| Итого при сгорании с избытком воздуха (α = 1,1) | 217,05 | 816,26 | 1033,35 | 99,2 | 198,37 | 816,26 | 19,7 | 1133,53 |
для С2Н6: N2/0,56 = 3,76; N2 = 2,1 и т.д.
Балластные газы СО2 и N2 переходят в продукты сгорания без изменения.
4. Определим теоретическое количество воздуха V0 (в итоге графы 6 табл. 9.1). Оно равно: 197,35 + 742,06 = 939,41 на 100 м3 газа, т.е. V0 = 939,41 м3/м3.
Количество избыточного воздуха Vизб = V0∙(1,1 - 1) = 939,41∙0,1 = 93,94.
5. Объем влаги (графа 8), который вносится с воздухом, составит:
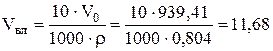 м3,
м3,
где ρ = 0,804 кг/м3 - плотность водяного пара при нормальных условиях.
6. Расход воздуха при α =1,1 составит Vв = 939,4∙1,1 = 1033,35 м3/м3.
7. Для определения О2 в продуктах сгорания (графа 10) необходимо из количества избыточного воздуха, расходуемого на горение, вычесть соответствующее количество азота:
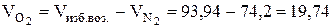 .
.
8. Дополнительное количество влаги с избыточным воздухом составит (см. графу 8):
Vдоп.вл.. = 11,68∙0,1 = 1,17.
9. Количество влажных продуктов сгорания в итоге графы 11 при α = 1,1 будет равно:
Vв.п.с. = 1133,53 / 100 = 11,33 м3/м3.
10. Объем водяных паров (см. графу 8)
Vв.п. = 198,37 / 100 = 1,98 м3/м3.
11. Количество сухих продуктов сгорания
Vс.п.с. = Vв.п.с. - Vв.п. = 11,33 - 1,98 = 9,35 м3/м3.
12. Определяем состав влажных продуктов сгорания: %:
СО2 = (99,2 / 1133,5)∙100 = 8,75;
Н2О = (108,37 / 1133,5)∙100 = 9,56;
О2 = (19,7 / 1133,5)∙100 = 1,74;
N2 = 100 - (СО2 + Н2О + О2) = 100 - (8,75 + 9,56 + 1,74) = 79,6.
В связи с тем, что расчет продуктов сгорания по составу топлива трудоемок и зачастую при выполнении теплотехнических расчетов отсутствует его полный анализ, в производственных условиях для расчетов пользуются формулами приближенного расчета горения.
Теоретическое количество воздуха для сгорания топлива
V0 = (1,09 / 4187)∙ 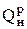 - 0,25, м3/м3,
- 0,25, м3/м3,
где 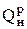 - низшая рабочая теплота сгорания газа, кДж/м3.
- низшая рабочая теплота сгорания газа, кДж/м3.
Теоретическое количество продуктов сгорания топлива
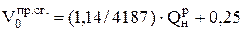 , м3/м3.
, м3/м3.
Пример 9.2. Определить количество воздуха, необходимое для сгорания природного газа с теплотой сгорания 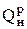 = 35600 кДж/м3, и объем продуктов горения при коэффициенте избытка воздуха α = 1,05.
= 35600 кДж/м3, и объем продуктов горения при коэффициенте избытка воздуха α = 1,05.
Решение:
1. Вычисляется теоретическое количество воздуха
V0 = (1,09 / 4187)∙ 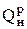 - 0,25 = (1,09 / 4187)∙35600 - 0,25 = 9,05, м3/м3.
- 0,25 = (1,09 / 4187)∙35600 - 0,25 = 9,05, м3/м3.
Действительное количество воздуха
Vд = V0∙α = 9,05∙1,05 = 9,5м3/м3.
3. Теоретический объем продуктов сгорания
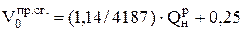 = (1,14 / 4167)∙35600 + 0,25 = 9,95м3/м3.
= (1,14 / 4167)∙35600 + 0,25 = 9,95м3/м3.
4. Действительный объем продуктов сгорания
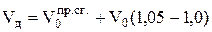 = 9,95 + 0,05 = 10,4 м3/м3.
= 9,95 + 0,05 = 10,4 м3/м3.
Дата добавления: 2015-12-22; просмотров: 2401;
