Первый закон термодинамики как закон сохранения и превращения энергии
Термодинамический метод основан на использовании всеобщего закона сохранения энергии при ее превращениях, согласно которому: энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических и химических процессах. Другими словами, для любой изолированной системы энергия, заключенная в этой системе, сохраняется неизменной.
Энергетическое состояние термодинамической системы и уровень ее собственной энергии определяется такой величиной как внутренняя энергия. Внутренняя энергия тела складывается из поступательного и вращательного движений молекул, составляющих тело, энергии внутримолекулярных колебаний, внутриатомной и внутриядерной энергии.
В термодинамике в основном рассматриваются термодинамические системы взаимодействующие с окружающей средой, то есть не являющиеся изолированными. В этом случае изменение внутренней энергии DU системы определяют, изучая род взаимодействия системы с окружающей средой. При этом важно, что характер изменений в термодинамической системе зависит не от свойств окружающих тел, а исключительно от способа передачи энергии, то есть от рода взаимодействия. Поэтому при составлении баланса энергии термодинамической системы алгебраически суммируются воздействия каждого рода, исходящие от всех тел окружающей среды. Если через Qk обозначить количество воздействий k–го рода, то уравнение сохранения энергии можно представить в виде:
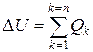 ,
,
где n – число родов взаимодействий, или число термодинамических степеней свободы системы.
Представленное уравнение является формой выражения первого закона термодинамики для произвольной термодинамической системы с многими степенями свободы, который может быть сформулирован так: изменение внутренней энергии термодинамической системы равно алгебраической сумме внешних воздействий.
При рассмотрении термодеформационной термодинамической системы таких внешних воздействий всего два: теплота и работа. Причем термическое воздействие, то есть количество подводимой теплоты Q, считается положительным в том случае, если теплота подводится от окружающей среды к термодинамической системе (рис. 2.1). А работа, наоборот, будет тогда положительной, когда система совершает работу над окружающей средой.
 Рис. 2.1. Внешние воздействия на термодинамическую систему
Рис. 2.1. Внешние воздействия на термодинамическую систему
| В технической термодинамике отдельно рассматривается работа объемной деформации системы и работа, не связанная с объемной деформацией. Механическая работа, совершаемая при объемной деформации, называется работой расширения и обозначается L. С учетом введенных обозначений и правила знаков уравнение первого закона термодинамики для термодеформационной системы получит вид: DU = Q – L, |
а первый закон следующую формулировку: изменение внутренней энергии термодинамической системы равно разности между количеством теплоты и работы.
Переписав представленное выражение в форме:
Q = DU + L,
можно получить еще одну формулировку первого закона термодинамики: подводимая к термодинамической системе теплота затрачивается на изменение внутренней энергии системы и на совершение работы.
Оба представленных выражения, определяют изменения в термодинамической системе, происшедшие в конечном термодинамическом процессе. В случае элементарного, бесконечно малого процесса теплота, работа и, следовательно, изменение внутренней энергии системы бесконечно малы. Тогда:
dU = dQ – dL или dQ = dU + dL.
Если масса системы неизменна и сама система представляет собой однородное рабочее тело, то уравнения первого закона термодинамики могут быть записаны в удельных величинах:
du = dq – dl или dq = du + dl.
Кроме работы расширения термодинамическая система может совершать и другие виды работ. Любой вид работы, за исключением работы расширения обозначим символом L*. Тогда уравнения первого закона термодинамики для элементарного процесса запишутся в виде:
du = dq – dl – ådl* или dq = du + dl + ådl*.
Дата добавления: 2015-11-26; просмотров: 2417;
