Уравнение первого закона термодинамики для закрытых систем
Подставив в общее уравнение первого закона термодинамики
du = dq – dl – dl*
выражения для элементарного количества теплоты dq = Tds и элементарной работы расширения dl = pdu, получим уравнение первого закона термодинамики для равновесных термодинамических процессов в закрытой термодинамической системе:
du = Tds – pdu – dl*.
Если система совершает только работу расширения, то будет получено основное уравнение термодинамики:
du = Tds – pdu или Tds = du + pdu.
При предыдущем рассмотрении было установлено, что ни теплота, ни работа не являются функциями состояния системы, то есть они зависят от вида термодинамического процесса. Является ли функцией процесса внутренняя энергия или же эта величина обладает иными свойствами?
Для ответа на этот вопрос рассмотрим круговой термодинамический процесс (цикл) и укажем еще одну формулировку первого закона термодинамики.
Уравнение первого закона термодинамики для цикла записывается следующим образом:
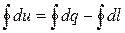 .
.
А еще одна формулировка первого закона термодинамики звучит так: вечный двигатель первого рода не существует, то есть такой двигатель, который давал бы полезную работу без затраты энергии извне. Это означает, что окружающая среда, получив определенное количество энергии за цикл в форме работы, должна отдать такое же количество энергии в форме теплоты:
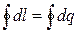 .
.
Тогда уравнение первого закона термодинамики для цикла может быть записано в виде:
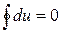 .
.
Эта форма записи указывает на то, что при осуществлении кругового термодинамического процесса (цикла) система возвращается в исходное состояние и внутренняя энергия системы остается без изменений. Таким образом, внутренняя энергия является функцией состояния системы, то есть таким же термодинамическим параметром, как, например, удельный объем, температура, давление, и изменение внутренней энергии не зависит от вида термодинамического процесса.
Следовательно, величины, упоминавшиеся до сих пор в связи с анализом энергетических взаимодействий системы, могут быть разделены на две группы: функции состояния (термодинамические параметры) и функции процесса.
Для определения изменения любой функции состояния в результате осуществления термодинамического процесса достаточно найти разность между конечным и начальным значениями анализируемой функции состояния. Например,
- изменение внутренней энергии
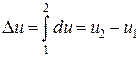 ;
;
- изменение давления
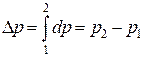 и т.д.
и т.д.
Для функций процесса dq и dl такого понятия как «изменение при осуществлении термодинамического процесса» не существует. Эти величины представляют собой лишь бесконечно малые количества передаваемой системе (или системой в окружающую среду) энергии в форме теплоты или работы. И для вычисления интегралов от этих величин необходимо знать уравнения процессов:
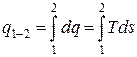 и
и 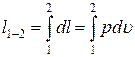 .
.
Итак, первый закон термодинамики для закрытых систем может быть записан в дифференциальной и интегральной формах:
du = Tds – pdu – dl* – дифференциальная форма;
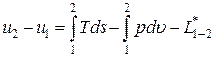 – интегральная форма.
– интегральная форма.
Если система совершает только работу расширения, то эти уравнения будут записаны следующим образом:
du = Tds – pdu или Tds = du + pdu;
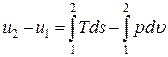 или
или 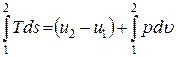 .
.
Дата добавления: 2015-11-26; просмотров: 1909;
