Состояние термодинамической системы, параметры состояния
При изучении механических систем вводятся такие понятия как: состояние движения или состояние покоя, т.е. свойства механической системы описываются по положению рассматриваемого тела относительно выбранной системы координат. Если хотя бы одна из трех координат с течением времени изменяется, то говорят, что тело движется, в противном случае – тело находится в состоянии покоя.
При изучении тепловых явлений тело в большинстве случаев находится в неподвижном состоянии. Поэтому, с помощью координатного метода, который применяется с успехом в механике, свойства тела (системы) не описать. Для описания свойств таких тел нужны какие-то другие координаты, которые обычно называются параметрами. Наиболее наглядным примером в этом плане может служить сам человек. Так, чтобы охарактеризовать состояние человека достаточно определить температуру его тела и артериальное давление. Сравнив реальные значения этих параметров с нормальными с точки зрения медицины, врач может сделать заключении о состоянии человека: болен он или здоров. Для уточнения состояния человека проводится детальное обследование, в ходе которого могут дополнительно определяться еще десяток параметров, характеризующих состояние человека.
Аналогично, существует совокупность физических величин, которые характеризуют состояние термодинамической системы, и называются термодинамическими параметрами состояния системы. Термодинамические параметры состояния позволяют количественно описать состояние термодинамической системы. Каждому состоянию системы соответствуют определенные значения термодинамических параметров. Следовательно, зная значения термодинамических параметров, можно достоверно определить состояние термодинамической системы в данный момент времени.
Термодинамические параметры состояния изменяются при взаимодействии термодинамической системы с окружающей средой.
Физические величины, применяемые в термодинамике, по ряду признаков делят на следующие группы: интенсивные и экстенсивные, калорические и термические.
Интенсивными называются такие параметры состояния, значения которых не изменяются, если рассматривать какую-либо часть системы, отделив ее (мысленно) от системы. Примерами интенсивных величин являются температура и давление.
Экстенсивными или аддитивными (суммируемыми) называются величины, значения которых пропорциональны количеству вещества, находящемуся в данной части системы или во всей системе. Если система рассматривается состоящей из отдельных частей, то значение экстенсивной величины для системы равно сумме значений этой величины для всех частей. Экстенсивными величинами являются объем, внутренняя энергия, количество теплоты, энтропия и др.
Если термодинамическая система физически однородна во всех своих частях, то удобно все расчеты проводить для некоторой единичной части этой системы. В зависимости от того, какие единицы используют для выделения такой единичной части, различают:
- удельные величины, отнесенные к 1 кг вещества;
- объемные величины, отнесенные к 1 м3 вещества;
- молярные величины, отнесенные к 1 моль вещества.
Будучи отнесены к единичной части системы, экстенсивные величины перестают зависеть от размеров системы, и приобретают свойства интенсивных величин.
Калорическими называются термодинамические величины, выражаемые в единицах энергии. Такими величинами являются сама энергия, количество теплоты, количество работы, энтропия и др.
Термическими называются величины, физический смысл которых не связан непосредственно с понятием энергии и которые выражаются через температуру, силы, размеры и т.п. Такими величинами являются, например, температура, давление и др.
Кроме того, различают понятия «параметр состояния» и «функция состояния». К параметрам состояния относятся те величины, которые имеют простую физическую природу и могут быть непосредственно измерены (температура, давление, плотность вещества). Функции состояния имеют более сложную природу, они недоступны для прямого измерения, и могут быть выражены через параметры состояния, с помощью соответствующих функциональных зависимостей.
Итак, если ограничиться рассмотрением простейших термодинамических систем (например, газов), то в качестве термодинамических параметров системы можно выделить следующие физические величины:
- термодинамическую температуру Т,
- абсолютное давление р,
- объем V.
Как известно, чтобы знать положение тела в пространстве, достаточно указать три его координаты. Аналогично, чтобы знать состояние термодинамической системы, достаточно указать три его основных параметра. Если численное значение хотя бы одного из параметров изменяется, то и состояние системы также изменяется.
Огромную роль в термодинамике играет понятие равновесного состояния системы, так как только равновесные состояния термодинамических систем и их изменения могут быть количественно описаны методами классической термодинамики.
Равновесным термодинамическим состоянием называется такое состояние тела, которое не изменяется во времени без внешнего энергетического воздействия и когда внутри самой системы отсутствуют потоки теплоты и вещества.
Рассмотрим понятие равновесия на конкретном примере. Пусть в цилиндре с подвижным поршнем находится газ. Переместим мгновенно поршень в сторону уменьшения объема и остановим его. Наш опыт позволяет отметить, что давление в цилиндре резко возрастает. Да, это так. Но если бы мы наблюдали за состоянием газа в цилиндре через бесконечно малые промежутки времени, то мы бы установили, что давление возросло в первую очередь возле стенки самого поршня (возникла волна возмущения), а затем оно начало выравниваться по всему объему газа. Такое состояние системы, когда в ее разных частях давление различно и на систему нет внешнего возмущающего энергетического воздействия, называется неравновесным. Однако в течение очень короткого промежутка времени система приходит в равновесное состояние, когда в ее различных местах давление становится одинаковым.
Неравновесным термодинамическим состоянием называется такое состояние изолированной системы, при котором интенсивные параметры системы имеют различные значения в ее различных частях, вследствие чего в ней протекают процессы, направленные на выравнивание значений этих параметров во всех точках системы и на установление равновесного состояния.
Если на систему нет внешнего энергетического воздействия, то в течение некоторого промежутка времени она приходит в равновесное термодинамическое состояние (давление, температура газа выравниваются по всему объему). Это промежуток времени, называемый временем релаксации, зависит от природы тела, характера взаимодействия частиц в системе и исходного неравновесного состояния. После истечения времени релаксации параметры изолированной системы принимают постоянные значения во всех частях системы и в дальнейшем не изменяются.
Таким образом, условием равновесного состояния является равномерное распределение по системе тех физических величин, различие в которых является причиной обмена энергией. Например, для равновесия термодеформационной системы во всех ее точках должны быть одинаковыми температура и давление.
Если система изолирована от внешних воздействий, то равновесие системы сохраняется неизменным неограниченно долго, то есть система, находящаяся в равновесном состоянии, не может самопроизвольно выйти из этого состояния.
Температурой называется скалярная физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
В зависимости от применяемой температурной шкалы температура имеет следующие специальные обозначения:
К – градусы по шкале Кельвина;
°С – градусы по шкале Цельсия;
°R – градусы по шкале Рэнкина;
°F – градусы по шкале Фаренгейта.
Все шкалы равноправны, но в современной термодинамике предпочтительной является абсолютная температурная шкала Кельвина. Поэтому во всех термодинамических соотношениях используется термодинамическая температура Т. В технике иногда применяется стоградусная шкала – шкала Цельсия. Величина градуса в обеих шкалах одинакова, поэтому пересчет с одной шкалы в другую производится по формуле:
Т = t + 273,15. (1.1)
Абсолютное давление численно равно силе, действующей по направлению нормали на единицу площади поверхности тела. Единицей измерения давления служит Паскаль (Па) – давление, вызываемое силой 1 Н, равномерно распределенной по поверхности площадью 1 м2 и нормальной к ней. Внесистемными единицами давления являются атмосфера и бар. Давление также может измеряться высотой столба жидкости, то есть в мм ртутного и водяного столба. Между единицами измерения существуют следующие соотношения:
1 бар = 105 Н/м2 = 1,01972 кгс/см2 = 750,06 мм рт. ст. = 10197 мм вод. ст.;
1 ат = 1 кгс/см2 = 735,6 мм рт. ст. = 10.000 мм вод. ст. = 98066 Н/м2.
Абсолютное давление складывается из двух составляющих атмосферного (барометрического) рбар и избыточного давлений ризб:
р = рбар + ризб. (1.2)
Атмосферное давление измеряется барометрами.
Избыточное давление может быть как положительным, так и отрицательным. Положительное избыточное давление в системе измеряется манометрами различной конструкции, поэтому положительное избыточное давление также называется манометрическим – рман. Отрицательное избыточное давление представляет собой вакуум в системе, который измеряется вакуумметрами, поэтому отрицательное избыточное давление называется вакуумметрическим – рвак.
Таким образом, для определения абсолютного давления необходимо знать показания барометра и манометра или вакуумметра:
р > рбар: р = рбар + рман.
р < рбар: р = рбар – рвак.
Объем V системы выражается в м3. Очень часто в термодинамических соотношениях применяется удельный объем вещества, представляющий собой объем, занимаемый единицей массы вещества:
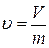 , м3/кг. (1.3)
, м3/кг. (1.3)
Иногда вместо удельного объема применяется обратная величина – плотность:
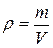 , кг/ м3. (1.4)
, кг/ м3. (1.4)
Дата добавления: 2015-11-26; просмотров: 2649;
