Уравнения состояния и термодинамические процессы
Как правило, при взаимодействии какого-либо рода в системе одновременно изменяются значения нескольких параметров состояния. Однако опыт показывает, что среди параметров состояния всегда имеется один (и только один) такой параметр, изменение которого в равновесных процессах вызывается взаимодействием только одного определенного рода.
Параметры состояния, обязательно изменяющиеся при наличии взаимодействия данного рода и не изменяющиеся под влиянием взаимодействий иных родов, называются координатами термодинамического состояния. Если происходит изменение некоторой координаты состояния, то можно утверждать, что происходит обмен энергией в соответствующей форме.
Так, при деформационном взаимодействии необходимым и достаточным условием передачи энергии в форме работы является перемещение поршня, на который действует сила давления газа. Перемещение поршня приводит к изменению объема рабочего тела в цилиндре.
Следовательно, координатой деформационного состояния однородного рабочего тела является его объем.
Координатой термического состояния рабочего тела является энтропия. Изменение энтропии свидетельствует о том, что изменение состояния термодинамической системы происходит в результате передачи энергии в форме теплоты.
Как известно, изменение равновесного состояния термодинамической системы возможно только в результате внешних воздействий, а воздействие каждого рода приводит к изменению значения одной из координат состояния. Значит, для определения состояния системы достаточно знать значения всех координат состояния, которые полностью и однозначно определяют данное равновесное состояние. Значение остальных параметров состояния определяются по значениям координат состояния, то есть каждый параметр равновесного состояния системы является однозначной функцией всех координат состояния.
Уравнения, представляющие зависимость параметров (функций) состояния равновесной системы от координат состояния, называются уравнениями состояния термодинамической системы.
Если обозначить произвольную функцию состояния системы через j, а координаты состояния – через х1, х2, …, хn (n – число координат состояния, то есть термодинамических степеней свободы), то уравнение состояния можно представить в виде:
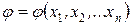 .
.
Например, состояние однородной термодеформационной системы описывается уравнениями, содержащими две независимые переменные: координату деформационного состояния – удельный объем u, координату термического состояния – удельную энтропию s. Остальные параметры (функции) состояния, например, температура и давление связаны со значениями координат соответствующими уравнениями состояния в виде:
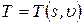 ;
; 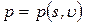 .
.
Температура и давление относятся к важной для термодинамического анализа группе величин, которая называется потенциалы термодинамических взаимодействий.
Потенциалом взаимодействия некоторого рода называется параметр состояния, различие значений которого между системой и окружающей средой на контрольной поверхности приводит к возникновению взаимодействия данного рода, то есть к передаче энергии в данной форме между системой и окружающей средой. Потенциалом для теплового взаимодействия является термодинамическая температура, а для деформационного механического взаимодействия – давление. Как правило, уравнения состояния содержат координаты и потенциалы термодинамической системы.
Представленные уравнения состояния для термодеформационной системы неудобны для практического применения, так как энтропия – неизмеряемая величина. Решая совместно эти уравнения, можно исключить энтропию, выразив ее через объем и температуру или через объем и давление. В результате получается термическое уравнение состояния, которое связывает давление, объем и температуру:
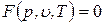 .
.
Уравнения состояния систем с двумя степенями свободы, являясь функциями с двумя независимыми переменными, позволяют построить некоторую поверхность, называемую термодинамической поверхностью или поверхностью состояния. Любое равновесное состояние системы изображается точкой, лежащей на этой поверхности. Если точка не лежит на поверхности состояния, то такое сочетание параметров состояния для данной системы невозможно.
Изменение состояния термодинамической системы в результате ее взаимодействия с окружающей средой называется термодинамическим процессом.
В результате осуществления термодинамического процесса происходит обмен энергией между системой и окружающей средой, который возможен лишь при наличии разности соответствующих потенциалов. А наличие разности потенциалов может привести к нарушению равновесия внутри термодинамической системы. Термодинамический процесс, протекающий с нарушением внутреннего равновесия в термодинамической системе, называется неравновесным.
Полное описание неравновесных процессов методами термодинамики невозможно вследствие неопределенности и чрезвычайно сложного характера изменений, происходящих при этом в системе. Поэтому для изучения принципиальных свойств систем при обмене энергией применяется идеализация реальных процессов и рассматриваются равновесные процессы.
Термодинамический процесс, протекающий с бесконечно малым отклонением состояния системы от равновесного состояния, называется равновесным.
При осуществлении равновесного процесса термодинамическая система проходит ряд бесконечно близких состояний, каждое из которых является равновесным. Каждое промежуточное состояние системы в процессе подчиняется уравнению состояния и изображается соответствующей точкой на термодинамической поверхности. Совокупность таких точек образует на поверхности состояний линию, которая называется линией термодинамического процесса.
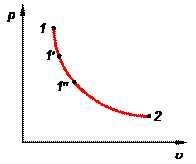 Рис. 1.2. Диаграмма состояния.
Рис. 1.2. Диаграмма состояния.
| В термодинамике широко используются графические методы анализа процессов. При этом удобнее использовать не пространственные трехмерные изображения линий процессов, а их двухмерные проекции на координатные плоскости. Координатные оси плоских диаграмм состояния соответствуют двум термодинамическим параметрам (рис. 1.2). Например, на р-u-диаграмме изображен какой-то равновесный процесс 1-2. Точки 1, 1¢, 1² и т.д. изображают равновесные состояния термодинамической системы. |
Лекция №2
Тема: «ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ»(2 часа)
1. ПЛАН
1. Первый закон термодинамики как закон сохранения и превращения энергии.
2. Свойства работы как формы обмена энергией.
3. Свойства теплоты как формы обмена энергией.
4. Уравнение первого закона термодинамики для закрытых систем
5. Уравнение первого закона термодинамики для открытых систем
2. ЛИТЕРАТУРА
Основная литература
1. Амерханов Р.А., Драганов Б.Х. Теплотехника. - М.: Энергоатомиздат, 2006. – 432 с.
Дополнительная литература
1. Теплотехника. /А.П. Баскаков, Б.В. Берг и др. – М.: Энергатомиздат, 1991. – 224 с.
2. Техническая термодинамика. / Кириллин В.А., Сычев В.В., Шейндлин А.Е. – М.: Издательский дом МЭИ, 2008. – 496 с.
Дата добавления: 2015-11-26; просмотров: 2085;
