Плазмолемма эритроцитов.
Плазмолемма эритроцита состоит из бислоя липидов и белков, представленных приблизительно в равных количествах, а также небольшого количества углеводов, формирующих гликокаликс. Большинство липидных молекул, содержащих холин (фосфатидилхолин, сфингомиелин), расположены во внешнем слое плазмолеммы, а липиды, несущие на конце аминогруппу (фосфатидилсерин, фосфатидилэтаноламин), лежат во внутреннем слое. Часть липидов (~ 5%) наружного слоя соединены с молекулами олигосахаров и называются гликолипидами. Распространены мембранные гликопротеины - гликофорины. С ними связывают антигенные различия между группами крови человека.
В плазмолемме эритроцита идентифицировано 15 главных белков с молекулярной массой 15-250 КД (рис. 3.4.). Более 60% всех белков составляют примембранный белок спектрин,мембранные белки - гликофорин и полоса 3.
 |
Рис. 3.4. Строение плазмолеммы и цитоскелета эритроцита.
А - схема: 1 - плазмолемма; 2 - белок полосы 3; 3 - гликофорин; 4 - спектрин (альфа- и бетта цепи); 5 - анкирин; 6 - белок полосы 4.1; 7 - узловой комплекс; 8 - актин.
Б - плазмолемма и цитоскелет эритроцита в сканирующем электронном микроскопе. 1 - плазмолемма; 2 - сеть спектрина.
Спектрин является белком цитоскелета, связанным с цитоплазматической стороной плазмолеммы, участвует в поддержании двояковогнутой формы эритроцита, обеспечивает эластичность эритроцита. Благодаря пластичности эритроцит способен проходить через капилляры, диаметр которых в 2 раза меньше, чем его диаметр.
При наследственной аномалии спектрина эритроциты имеют сферическую форму. При недостаточности спектрина в условиях анемии эритроциты также принимают сферическую форму. Соединение спектринового цитоскелета с плазмолеммой обеспечивает внутриклеточный белок анкирин. Анкирин связывает спектрин с трансмембранным белком плазмолеммы (полоса 3). Гликофорин - трансмембранный белок(30 КД), который пронизывает плазмолемму в виде одиночной спирали, и его большая часть выступает на наружной поверхности эритроцита, где к нему присоединены 15 отдельных цепей олигосахаридов, которые в сумме составляют 60 % массы гликофорина и несут отрицательные заряды.
Гликофориныотносятся к классу мембранных гликопротеинов, которые выполняют рецепторные функции. Гликофорины обнаружены только в эритроцитах. Полоса 3представляет собой трансмембранный гликопротеид (100 КД), полипептидная цепь которого много раз пересекает бислой липидов. Этот гликопротеид участвует в обмене О2 и СО2, которые связывают гемоглобин - основной белок цитоплазмы эритроцита. Эритроциты в легких отдают СО2 путем замены анионов НСО3 на Сl. Белок полосы 3 обеспечивает этим анионам трансмембранный проход через гидрофильные «поры», окруженные гидрофобными липидными зонами. Таким образом, формируются водные ионные каналы.
Эритроцит имеет отрицательный заряд поверхности. Он появляется на плазмолемме только зрелых эритроцитов, что служит своеобразным пропуском для выхода из костного мозга в кровоток. Наличие отрицательного заряда имеет важное функциональное значение для эритроцита. Старые эритроциты его утрачивают, что, возможно, служит одним из сигналов выбраковки таких эритроцитов. Эритроциты движутся в сосудах, образуя стройные кольца, плоскость которых перпендикулярна оси сосуда. Чем ближе к стенке, тем меньше скорость движения. Разница в скорости вращает эритроцит. При вращении заряженного эритроцита возникает круговой ток, образующий магнитное поле. Каждый эритроцит становится маленьким магнитом. Обращены они друг к другу одноименными зарядами, что приводит к отталкиванию соседа и устойчивости кольца. При разветвлении сосуда кольцо рассыпается и потом собирается вновь. Способность эритроцитов к намагничиванию А.Л.Чижевский объяснял чувствительностью системы крови к колебаниям магнитного поля Земли. В вытекающей из сосудов свежей крови можно видеть стопки склеенных эритроцитов - «монетные столбики», как проявление нарушения сил отталкивания в остатках колец.
Цитоплазма эритроцита состоит из воды (60 %) и сухого остатка (40 %), содержащего около 95 % гемоглобина и 5 % других веществ. Наличие гемоглобина обусловливает желтую окраску отдельных эритроцитов свежей крови, а совокупность эритроцитов - красный цвет крови.
Гемоглобин (Нв) - основная составная часть эритроцита. На его долю приходится 90% сухого веса клетки. Появление Нв и помещение его внутрь специализированной клетки является важным эволюционным преобразованием. Так как растворимость О2 невелика, необходимость транспортировки его больших количеств требовало увеличения объема крови, что привело бы к значительному возрастанию размеров животных. Поэтому появляются другие механизмы его транспорта.
Многие высокоорганизованные животные ( а позвоночные почти все без исключения) имеют кровь способную обратимо связывать большое количество кислорода. Вещества, которые служат переносчиками кислорода в крови - это белки, содержащие металл (обычно железо или медь). Они, как правило, окрашены и поэтому их называют дыхательными пигментами. Например, гемоцианин содержащий медь, встречается у моллюсков, членистоногих. Наиболее распространенным железосодержащим дыхательным пигментом является гемоглобин. Дыхательные пигменты могут быть растворены в плазме (гемоцианин у моллюсков и т.д.), у позвоночных они заключены в клетки (эритроциты). Когда пигменты заключены в клетки, их молекулярные веса относительно невелики (20000-120000), если они растворены в плазме - молекулярные веса намного больше - от 400000 до нескольких млн.
Плазма крови содержит около 7% белков, эритроциты содержат 35% гемоглобина. Если бы он был растворен в плазме, то концентрация белков в ней достигла бы 20%. Это был бы очень вязкий, сиропообразный раствор затрудняющий гемодинамику.
Концентрация гемоглобина в крови высших позвоночных относительно постоянна (около 15г. гемоглобина на 100 мл. крови) и не зависит от размеров животного. Это значение оптимально для нагрузки на сердце. Более высокая концентрация гемоглобина связана с исключительными потребностями. Например, у ныряющих животных необходимость увеличении запасов кислорода в крови заставляет нарушать ограничения на рост концентрации гемоглобина. Возрастание Нв в плазме вело бы и к возрастанию онкотического давлении, следовательно, увеличению ОЦК.
Гемоглобин.
Гемоглобин - это хемопротеин, окрашивающий эритроцит в красный цвет после присоединения к содержащемуся в нем железу (Fe++) молекулы кислорода. У мужчин в 1 дкл содержится 14,5±1,5г гемоглобина, у женщин - 13,0±1,5г. Молекулярная масса гемоглобина составляет около 60 000. Его молекула состоит их четырех субъединиц, каждая из которых представлена гемом (содержащим железо производным порфирина), связанным с белковой частью молекулы - глобином. Глобин представлен двумя а- и двумя b-полипептидными цепями. Синтез гема протекает в митохондриях эритробластов, первым этапом которого является синтез a-амино- b- кетоадипиновой кислоты из глицина и сукцинил Коэнзима A. Синтез цепей глобина идет на полирибосомах и контролируется генами 11 и 16 хромосом. У взрослого человека глобин состоит из двух a- и двух b-полипептидных цепей. Гемоглобин, содержащий две а- и две b-цепи, называется А тип (от adult - взрослый). Он составляет основную часть нормального гемоглобина взрослого человека. В крови плода человека содержится гемоглобин типа F (от faetus - плод). Его глобин представлен двумя цепями а и двумя b.
При ряде заболеваний (гемоглобинозы, гемоглобинопатии) в эритроцитах появляются другие виды гемоглобинов, которые характеризуются изменением аминокислотного состава в белковой части гемоглобина.
В настоящее время выявлено более 150 видов аномальных гемоглобинов. Например, при серповидно-клеточной анемии имеет место генетически обусловленное повреждение в бетта-цепи гемоглобина - глютаминовая кислота, занимающая 6-е положение в полипептидной цепи, заменена на аминокислоту валин. Такой гемоглобин обозначается как HbS (от англ. sickle - серп). При этом эритроциты имеют форму серпа. В ряде стран тропического пояса определенный контингент людей являются гетерозиготными для генов серповидно - клеточной анемии, а дети двух гетерозиготных родителей по законам наследственности дают либо нормальный тип (25 %), либо бывают гетерозиготными носителями, и 25 % страдают серповидно-клеточной анемией.
3.3.1 Основные соединения гемоглобина:
1. НвО2 - оксигемоглобин, имеет ярко - красный цвет, содержится в артериальной крови. Образуется в результате реакции оксигенации Нв +О2 ↔ НвО2
2. Нв - восстановленный или дезоксигемоглобин - имеет темно - вишневый цвет, содержится в венозной крови.
3. НвСО2 - карбогемоглобин.
4. НвСО - карбоксигемоглобин. Нв + угарный газ (СО в N - 1%, у курильщиков - 3%. Средство Fe гемоглобина к СО превышает его сродство к О2. Поэтому даже 0,1% СО в воздухе ведет к превращению 80% Нв в НвСО, который не диссоциируется , что опасно для жизни.
5. Met Нв НвОН - метгемоглобин, содержит Fe 3*, имеет коричневый цвет. Образуется под влиянием сильных окислителей (перманганат К, бертолетова соль и т.д.). При его накоплении транспорт О2 прекращается и может наступить смерть.
6. Миоглобин - находится в мышцах, миокарде. Его простетическая группа идентична гемоглобину крови, а белковая часть - обладает меньшей молекулярной массой. Миоглобин человека связывает до 14% общего количества О2 в организме. Это его свойство играет важную роль в снабжении работающих мышц О2. При их сокращении сосуды сдавливаются, кровоток уменьшается. Однако благодаря миоглобину снабжение мышц О2 сохраняется.
7. Гликированный гемоглобин. В норме 6-7% гемоглобина связано с глюкозой. Главной формой гликированного гемоглобина (гликогемоглобин) является гемоглобин А1с, который в норме составляет 4-6% общего гемоглобина.Так как эритроцит живет 120 дней, величина гликированного гемоглобина А1с является маркером состояния контроля диабета в течении 8-12 предшествующих недель до его исследования. Количество Нв в крови здоровых людей 140-160 г\л (муж.), 120-140 г\л (жен).
При разрушении эритроцитов (старых или воздействии различных факторов - токсины, радиации и др.) Нв выходит из клеток, и это явление называется гемолизом. При этом в крови обнаруживаются тени (оболочки) эритроцитов, а кровь приобретает красный цвет и становится прозрачной (лаковая кровь).
Таблица 3.1.
Виды гемолиза
| Вид гемолиза | Условия возникновения |
| 1. Осмотический | Понижение осмотического давления плазмы крови |
| 2. Механический | Механическое повреждение эритроцитов. |
| 3. Химический | Воздействие различных химических веществ |
| 4. Биологический | Укусы змей и действие других биологических ядов |
| 5. Термический | Действие низких и высоких температур |
| 6. Иммунологический | Переливание крови, несовместимой по групповому или резус-признаку, воздействие чужеродных антигенов. |
Осмотический гемолиз может возникнуть в гипотонической среде. Концентрация раствора NаСl, при которой начинается гемолиз, носит название осмотической резистентности эритроцитов. Для здоровых людей границы минимальной и максимальной стойкости эритроцитов находятся в пределах от 0,4 до 0,34%.
Химический гемолиз может быть вызван хлороформом, эфиром, разрушающими белково-липидную мембрану эритроцитов.
Биологический гемолиз встречается при действии ядов змей, насекомых, микроорганизмов, иммунологический при переливании несовместимой крови под влиянием иммунных гемолизинов.
Термический гемолиз возникает при замораживании и размораживании крови в результате разрушения оболочки эритроцитов кристалликами льда.
Механический гемолиз происходит при сильных механических воздействиях на кровь, например встряхивании ампулы с кровью.
Выход Нв в кровь чреват развитием тяжелых осложнений.
Возрастание концентрации Нв в плазме крови ведет к резкому возрастанию вязкости крови, онкотического давления. Обьем циркулирующей крови, что затрудняет гемодинамику. Кроме того, Нв в плазме крови большой концентрации оказывает токсическое действие на нейроны, почки (почечный фильтр). В русле крови Нв быстро окисляется в метгемоглобин, а в эритроцитах есть ферментные системы, препятствующие этому.
Старые гемоциты разрушаются макрофагами главным образом в селезенке, а так в печени и костном мозге, при этом НЬ распадается на пигмент билирубин и гемосидерин - аморфные агрегаты, содержащие железо. Железо гемосидерина связывается с трансферриновым белком плазмы, содержащим железо, и захватывается специфичными макрофагами костного мозга. В процессе эритропоэза эритроциты и макрофаги передают трансферрин в формирующиеся эритроциты, что является основанием назвать их клетками-кормилками.
Транспорт кислорода кровью. Кислород в крови находится в растворенном виде и в соединении с гемоглобином. В плазме растворено очень небольшое количество кислорода. Эта фракция физически растворенного кислорода играет важную роль, так как кислород, который поступает из воздуха в кровь или из крови в ткани проходит стадию растворения, так как только в таком виде он может диффундировать, но поскольку растворимость кислорода при 37оС составляет 0,225 мл ×л-1×кПа-1 (0,03 мл ×л-1×мм рт.ст-1), то каждые 100 мл плазмы крови при напряжении кислорода 13.3 кПа (100 мм р.с.) могут переносить в растворенном состоянии лишь 0.3 мл кислорода. Это явно недостаточно для жизнедеятельности организма.
 Растворимость газов в жидкостях подчиняется закону Генри-Дальтона: количество растворенного газа пропорционально парциальному напряжению газа. Коэффициент пропорциональности (коэффициент Бунзене) для кислорода равен 0,024 мл на 1 мл растворителя в расчете на 1 атм. (760 мм рт.ст). Вот почему фракция растворенного кислорода так мала. Однако её можно увеличить (например, при гибербарической оксигенации).
Растворимость газов в жидкостях подчиняется закону Генри-Дальтона: количество растворенного газа пропорционально парциальному напряжению газа. Коэффициент пропорциональности (коэффициент Бунзене) для кислорода равен 0,024 мл на 1 мл растворителя в расчете на 1 атм. (760 мм рт.ст). Вот почему фракция растворенного кислорода так мала. Однако её можно увеличить (например, при гибербарической оксигенации).
Таблица 3.2
Таблица 3.3.

Каждый грамм гемоглобина способен связать 1.39 мл кислорода и, следовательно, при содержании, гемоглобина 150 г/л каждые 100 мл крови могут переносить 20.8 мл кислорода. Величина, отражающая количество кислорода, которое может связаться с гемоглобином при его полном насыщении, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание кислорода вкрови, которое отражает истинное количество кислорода, как связанного с гемоглобином, так и физически растворенного в плазме. В 100 мл артериальной крови в норме содержится 19-20 мл кислорода, в таком же объеме венозной крови - 13-15 мл кислорода, при этом артерио-венозная разница составляет 5-6 мл. Отношение количества кислорода, связанного с гемоглобином, к кислородной емкости последнего является показателем степени насыщения гемоглобина кислородом. Насыщение гемоглобина артериальной крови кислородом у здоровых лиц составляет 96%.
Образование оксигемоглобинав легких и его восстановление в тканях находится в зависимости от парциального напряжения кислорода крови: при его повышении. Насыщение гемоглобина кислородом возрастает, при понижении - уменьшается. Эта связь носит нелинейный характер и выражается кривой диссоциации оксигемоглобина, имеющей S-образную форму (рис.3.3.). Оксигенированной артериальной крови соответствует плато кривой диссоциации, а десатурированной крови в тканях - круто снижающаяся ее часть. Пологий подъем, кривой в верхнем ее участке (зона высокого напряжения 02) свидетельствует, что достаточно полное насыщение гемоглобина артериальной крови кислородом обеспечивается даже при уменьшении напряжения 02 до 9.3 кПа (70мм рт.ст.). Понижение напряжения 02 с 13.3 кПа на 2.0-2.7 кПа (со 100 на 15-20мм рт.ст.) практически не отражается на насыщении гемоглобина кислородом (Нb02 снижается при этом на 2-3%). При более низких значениях напряжения 02 оксигемоглобин диссоциирует значительно легче (зона крутого падения кривой). Так, при снижении напряжения 02 с 8.0 до 5.3 кПа (с -60 до 40мм рт.ст.) насыщение гемоглобина кислородом уменьшается приблизительно на 15%.
Положение кривой диссоциации оксигемоглобина количественно принято выражать парциальным напряжением кислорода, при котором насыщение гемоглобина составляет 50% (Р50). Нормальная величина Р50 при температуре 37°С и рН 7.40 - около 3.53 кПа (26.5мм рт.ст.).
Кривая диссоциации оксигемоглобина при определенных условиях может смещаться в ту или иную сторону, сохраняя S-образную форму, под влиянием изменения рН, напряжения С02, температуры тела, содержания в эритроцитах 2,3-дифосфоглицерата (2,3 - ДФГ), от которых зависит способность гемоглобина связывать кислород. В работающих мышцах в результате интенсивного метаболизма повышается образование С02 и молочной кислоты, а также возрастает теплопродукция. Все эти факторы понижают сродство гемоглобина к кислороду. Кривая диссоциации при этом сдвигается вправо (рис.3.3.), что приводит к более легкому освобождению кислорода из оксигемоглобина, и возможность потребления тканями кислорода увеличивается. При уменьшении температуры, 2,3-ДФГ, снижении напряжения С02 и увеличении рН кривая диссоциации сдвигается влево, сродство гемоглобина к кислороду возрастает, в результате чего доставка кислорода к тканям уменьшается.
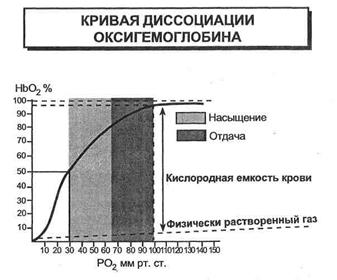
Рисунок 3.5.
Транспорт кровью углекислого газа. Являясь конечным продуктом обмена веществ, С02 находится в организме в растворенном и связанном состоянии. Коэффициент растворимости С02 составляет 0.231 ммоль-л-1 кПа-1 (0.0308 ммоль-л-1мм рт.ст-1), что почти в 20 раз выше, чем у кислорода. Однако, в растворенном виде переносится меньше 10% всего количества С02, транспортируемого кровью. В основном, С02 переносится в химически связанном состоянии, главным образом, в виде бикарбонатов, а также в соединении с белками (так называемые карбоминовые,или карбосоединения).
Таблица 3.4.

В артериальной крови напряжение С02 5.3 кПа (40мм рт.ст.), в интерстициальной жидкости его напряжение составляет 8.0-10.7 кПа (60-80 мм рт.ст.). Благодаря этим градиентам, образующийся в тканях С02 переходит из интерстициальной жидкости в плазму крови, а из нее - в эритроциты. Вступая в реакцию, с водой, С02 образует угольную кислоту: С02 + Н20 Û Н2С03. Реакция эта обратима и в тканевых капиллярах идет преимущественно в сторону образования: Н2С03. В плазме эта реакция протекает медленно, но в эритроцитах образование угольной кислоты под влиянием фермента ускоряет реакцию гидратации С02 в 15000-20000 раз. Угольная кислота диссоциирует на ионы Н+ и НС03-. Когда содержание ионов НС03- повышается, они диффундируют их эритроцита в плазму, а ионы Н+ остаются в эритроците, так как мембрана эритроцита сравнительно непроницаема для катионов. Выход ионов НС03- в плазму уравновешивается поступлением из плазмы ионов хлора. При этом в плазме высвобождаются ионы натрия, которые связываются поступающими из эритроцита ионами НС03-, образуя NaHC03. Гемоглобин и белки плазмы, проявляя свойства слабых кислот, образуют соли в эритроцитах с калием, а в плазме с натрием. Угольная кислота обладает более сильными кислотными свойствами, поэтому при ее взаимодействии с солями белков ион Н+ связывается с белковым анионом, а ион НС03- с соответствующим катионом образует бикарбонат (в плазме NaHC03, в эритроците КНС03).
В крови тканевых капилляров одновременно с поступлением С02 внутрь эритроцита и образованием в нем угольной кислоты происходит отдача кислорода оксигемоглобином. Восстановленный гемоглобин представляет собой более слабую кислоту (т.е. лучший акцептор протонов), чем оксигенированный. Поэтому он легче связывает водородные ионы, образующиеся при диссоциации угольной кислоты. Таким образом, присутствие восстановленного гемоглобина в венозной крови способствует связыванию С02, тогда как образование оксигемоглобина в легочных капиллярах облегчает отдачу углекислого газа.
В переносе кровью С02 большое значение имеет также химическая связь С02 с конечными аминогруппами белков крови, важнейший из которых - глобин в составе гемоглобина. В результате реакции с глобином образуется так называемый карбаминогемоглобин. Восстановлений гемоглобин обладает большим сродством к С02, чем оксигемоглобин. Таким образом, диссоциация оксигемоглобина в тканевых капиллярах облегчает связывание Нв02, способствует выведению углекислого газа выражается кривой диссоциации оксигемоглобина, имеющей S-образную форму (рис.3.5.). Оксигенированной артериальной крови соответствует плато кривой диссоциации, а десатурированной крови в тканях - круто снижающаяся ее часть. Пологий подъем кривой в верхнем ее участке (зона высокого напряжения 02) свидетельствует, что достаточно полное насыщение гемоглобина артериальной крови кислородом обеспечивается даже при уменьшении напряжения 02 до 9.3 кПа (70 мм рт.ст.). Понижение напряжения 02 с 13.3 кПа на 2.0-2.7 кПа (со 100 на 15-20 мм рт.ст.) практически не отражается на насыщении гемоглобина кислородом (Нb02 снижается при этом на 2-3%). При более низких значениях напряжения 02 оксигемоглобин диссоциирует значительно легче (зона крутого падения кривой). Так, при снижении напряжения 02 с 8.0 до 5.3 кПа (с -60 до 40мм рт.ст.) насыщение гемоглобина кислородом уменьшается приблизительно на 15%.
Положение кривой диссоциации оксигемоглобина количественно принято выражать парциальным напряжением кислорода, при котором насыщение гемоглобина составляет 50% (Р50). Нормальная величина Р50 при температуре 37°С и рН 7.40 - около 3.53 кПа (26.5 мм рт.ст.).
Кривая диссоциации оксигемоглобина при определенных условиях может смещаться в ту или иную сторону, сохраняя S-образную форму, под влиянием изменения рН, напряжения С02, температуры тела, содержания в эритроцитах 2,3-дифосфоглицерата (2,3 - ДФГ), от которых зависит способность гемоглобина связывать кислород. В работающих мышцах в результате интенсивного метаболизма повышается образование С02 и молочной кислоты, а также возрастает теплопродукция. Все эти факторы понижают сродство гемоглобина к кислороду. Кривая диссоциации при этом сдвигается вправо, что приводит к более легкому освобождению кислорода из оксигемоглобина, и возможность потребления тканями кислорода увеличивается. При уменьшении температуры, 2,3-ДФГ, снижении напряжения С02 и увеличении рН кривая диссоциации сдвигается влево, сродство гемоглобина к кислороду возрастает, в результате чего доставка кислорода к тканям уменьшается.
Из общего количества С02, которое может быть извлечено из крови, лишь 8-10% С02 находится в соединении с гемоглобином. Однако, роль этого соединения в транспорте С02 кровью достаточно велика. Примерно 25-30% С02, поглощаемого кровью в капиллярах большого круга, вступает в соединение с гемоглобином, а в легких - выводится из крови.
Когда венозная кровь поступает в капилляры легких, напряжение С02 в плазме снижается и находящийся внутри эритроцита в физически растворенном виде С02 выходит в плазму. По мере этого, Н2С03 превращается в С02 и воду (рис.3.7. Б), причем карбоангидраза катализирует реакцию, идущую в этом направлении. Н2С03 для такой реакции доставляется в результате соединения ионов НС03- с ионами водорода, высвобождающихся из связи с белковыми анионами.

|
Рис.3.6. Схема процессов, происходящих в плазме и эритроцитах при газообмене в тканях (А) и легких (Б).
В состоянии покоя с дыханием из организма человека удаляется 230 мл С02 в минуту или около 15000 ммоль в сутки. Поскольку С02 является "летучим" ангидридом угольной кислоты, при его удалении из крови исчезает примерно эквивалентное количество ионов водорода. Поэтому дыхание играет важную роль в поддержании кислотно-щелочного равновесияво внутренней среде организма. Если в результате обменных процессов в крови увеличивается содержание водородных ионов, то, благодаря гуморальным механизмам регуляции дыхания, это приводит к увеличению легочной вентиляции (гипервентиляции).При этом молекулы С02, образующиеся в процессе реакции НС03- + Н+ Н2С03 Н20 + С02, выводятся в большем количестве и рН возвращается к нормальному уровню.
Зрелые эритроциты не имеют митохондрий и рибосом. Они способны синтезировать Нb и нуклеотиды из их низкомолекулярных предшественников. В них не происходит окислительные фосфорилирование, и цикл трикарбоновых кислот, т.е. эритроцит вырабатываемый мало энергии, т.е. АТФ.
Ферментные системы эритроцитов представлены ферментными системами гликолиза, пентозного цикла и глютатион пероксидазной ферментной системой, т.е. метаболизм эритроцитов отличается от метаболизма других клеток.
Ферментная система гликолиза - это анаэробное превращение глюкозы: из одной молекулы глюкозы образуется 2 молекулы АТФ и 2 молекулы молочной кислоты, ферментная система гликолиза обеспечивает эритроцит: 1) АТФ; 2) восстановленным НАД+Н+, который необходим для превращения Fe3+ в Fe2+ 3) дифосфоглицератом, который является внутриклеточным регулятором функций Нb.
Несмотря на малую энергетическую эффективность процесс гликолиза в эритроцитах обеспечивает все потребности клеток в энергии как для самого их существования, так и для проявления их функций.
Кроме гликолиза в эритроците имеет место прямое окисление глюкозы, идущее по пути пентозофосфатного цикла. Этим путем в норме осуществляется превращение только 10-11% глюкозы. Эта система обеспечивает эритроцит НАД Ф+Н+, который является компонентом антиоксидантной системы и необходим для образования глютатиона.
Глютатион пероксидазная система - это антиоксидантная система, которая защищает от окисления многочисленные ферменты эритроцитов, содержащих SH - групп.
Продолжительность жизни и старение эритроцитов. Средняя продолжительность жизни эритроцитов составляет около 120 дней. В организме ежедневно разрушается около 200 млн. эритроцитов. При их старении происходит изменения в плазмолемме эритроцита. Отмечаются изменения цитоскелетного белка спектрина, что приводит к преобразованию дисковидной формы эритроцита в сферический. В плазмолемме появляются специфические рецепторы к ауто анти телам, которые при взаимодействии с этими антителами образуют комплексы, обеспечивающие «узнавание» их макрофагами и последующий фагоцитоз. В стареющих эритроцитах снижаются интенсивность синтеза и соответственно содержание АТФ. Вследствие нарушения проницаемости плазмолеммы снижается осмотическая резистентность, наблюдается выход из эритроцитов ионов К+ в плазму и увеличение в них содержания Na+. При старении эритроцитов отмечается нарушение их газообменной функции.
ГРУППЫ КРОВИ
Мембрана эритроцитов являются носителями многочисленных антигенов, которые обладают определенной специфичностью и вызывают против себя образование одноименных антител.
Антигены, благодаря которым различные особи или группы особей животных одного вида различаются между собой, получили название изоантигенов. Для человеческих эритроцитов, кроме изоантигенов АВО, известно более 70 других, объединенных в 15 изоантигенных систем: АВО, MN(Ss), Pp, Rh-hr, Келл-Челлано, Даффи, Льюис, Лютеран, Кид и другие. Первые четыре системы групп крови (АВО, MN(Ss), Pp, Rh-hr) были открыты и изучены Ландштейнером. Этим открытием было положено начало иммуногематологии и иммунопатологии, которые после смерти ученого получили дальнейшее развитие и привели к открытию новых систем групп крови.
Кровь каждого человека имеет определенный антигенный состав и отражает его индивидуальность.
Система АВО - это первая система, открытая Ландштейнером в 1901г. Он установил существование в мембране эритроцитов двух агглютиногенов (антигенов): А, В и предположил существование в сыворотке соответствующих агглютининов (антител) - анти-А (ά) и анти-В (β). В эритроцитах антигена они могут быть по одному или вместе или отсутствовать. В плазме находятся агглютинирующие агенты (a и β),способствующие склеиванию эритроцитов. В крови разных людей содержатся либо один, либо два, либо ни одного агглютинина. При переливании несовместимой крови эритроциты не только склеиваются, но и разрушаются (гемолиз). Агглютиноген А и агглютинин a, а также В и β являются одноименными. Склеивание эритроцитов происходит в том случае, если эритроциты донора встречаются с одноименными агглютининами реципиента. Следовательно, в крови каждого человека находятся разноименные агглютинин и агглютиноген, т.е. никогда не встречаются одновременно агглютинин А с агглютинином a и агглютиноген В с агглютинином β, поэтому в организме агглютинации собственных эритроцитов не происходит.
Установлено, что всех людей можно по наличию или отсутствию в эритроцитах агглютининогенов А и В, а в плазме крови агглютининов a и β разделить на 4 группы. У людей I группы по классификации Янского эритроциты не содержат агглютиногенов, а в плазме имеются агглютинины a и β. У людей II группы в эритроцитах имеется агглютиноген А и в плазме - агглютинин В. К Ш группе относятся люди, у которых в эритроцитах находится агглютиноген В. Кровь людей IV группы характеризуется наличием в эритроцитах агглютиногенов А и В и отсутствием в плазме агглютининов a β (табл.4.1).
У людей имеются 4 комбинации агглютиногенов и агглютининов системы АВО. Они обозначаются следующим образом: I (O) - a β II (A) - Aβ, III (B), IV (AB).
Таблица 4.1
Система АВО
| Группа | I (0) | II (A) | III (B) | IV (AB) |
| Антигены эритроцитов | О | О, А | О, В | О, А, В |
| Антитела в плазме | антиА, ά антиВ, β | антиВ, ά | антиА, β | Нет о |
В процессе изучения свойств агглютиногенов Дунгерп и Гиршельд обратили внимание на то, что агглютиноген А не является однородным, а подразделяется на подгруппы А1 - А7. Основное различие в подгруппах заключается в том, что А1 является самым сильным антигеном, обладающим наибольшими агглютинационными и адсорбционными способностями, в то время как подгруппы А2-А7 обладают слабыми антигенными свойствами и последовательно проявляют все более низкие агглютационные и адсорбционные способности. В связи с этим различают подгруппы групп крови. В частности I группа делится на подгруппы А1 и А2.
Антигены А и В присутствуют в органах и тканях человека, обнаруживаются в секреторных жидкостях, экссудатах, транссудатах, в слюне, желудочном соке, грудном молоке.
Доказано также присутствие в лейкоцитах и тромбоцитах агглютиногенов системы АВО, идентичных агглютиногенам эритроцитов. Степень выраженности агглютиногенов зависит от некоторых патологических состояний человека, когда антигены системы АВО могут не выделяться и снова обнаруживаться в состоянии ремиссии. Агглютиногены эритроцитов и тромбоцитов обладают иммуногенными свойствами.
Групповые свойства крови передаются по наследству как два аллеломорфных признака, полученных один от отца, второй - от матери. Группоспецифические факторы А, В, О являются генетически обусловленными. Их связывают с 9 хромосомой. Наследование групповых субстанций - агглютиногенов О, А, В - происходит аутосомно по кодоминантному типу.
Фенотипически различают 4 группы крови, но генетически имеется 6 комбинаций аллельных антигенов - ОО, АО, АА, ВО, ВВ, АВ. Это объясняется тем, что 3 аллельных гена групповых субстанций Iо IА IВ, расположенные по одному на одной хромосоме, при образовании зигот могут создавать гомо- и гетерозиготные варианты, во второй группе - ОА, АА, в третьей - ОВ, ВВ. Гетеро- и гомозиготные варианты причисляют к одной группе крови, так как они не обладают разнокачественными свойствами. Первая группа крови содержит только антиген О. Она всегда гомозиготна в противоположность четвертой, которая содержит 2 антигена А и В.
Групповые свойства системы АВО проявляются у человека в ранние сроки эмбрионального развития. Группа крови человека является постоянным признаком и не изменяется в течение всей жизни.
Принципы наследования групп крови по АВО используются в судебно-медицинской практике для определения отцовства, т.к. мужчина с группой крови АВ не может быть отцом ребенка с группой крови О, хотя при использовании одного только этого критерия вероятность ошибки составляет 10%. Чем больше учитывается групповых факторов, тем с большей степенью надежности может быть исключено отцовство (в настоящее время можно достичь вероятности 99%0.
Кроме того, эти закономерности используются при изучении генетики популяций, т.к. для различных популяций характерна широкие вариации по этому признаку. У американских индейцев басков (живущих в Северной Испании) и туземцев Австралии группа крови О вообще не встречается.
Можно указать на карте все регионы, где частота аллелей, отражающая группу крови В, меньше 5% или больше 25%. Частота аллелей, определяющая группу В>25% на краю Восточной Европы - отсюда она уменьшается во всех направлениях, пока не падает менее 8% во Франции, Испании Португалии, Скандинавии и в других направлениях по направлению к Индийскому океану через всю Азию.
Предполагается, что аллели, определяющие тип В были занесены в Европу миграциями людей из Азии. Эти люди добавили свои аллели группы В к пулам генов людей, уже живущих в Европе.
Более 40% жителей Центральной Европы имеют группу крови А, примерно 40% - группу О, меньше 10% - В, 6% - АВ. У 90% коренных жителей Северной Америки встречается группа О. Более 20% населения Центральной Азии имеют группу крови В. Эти данные имеют важное значение для изучения происхождения и смешения народностей.
Групповые антигены, а в частности система АВО является генетическим маркером. Установлена взаимосвязь различных заболеваний, диагностированных у различных лиц с их группой крови. Например, пиелонефритом чаще болеют люди с О (I) группой крови.
Гемофилия А, тромбоцитопеническая болезни чаще встречаются у лиц с О (I) группой крови. Лица с группой крови А(II) чаще болеют раком желудка и яичников, тяжелым ревматоидным артритом, чаще наблюдаются воспалительные процессы, вызванные стафилококом, лямблиоз.
У индивидуумов с группой крови О(I) чаще развиваются болезни бронхолегочной системы, туберкулез легких, аллергические состояния, почечно-каменная болезнь.
Дата добавления: 2015-12-16; просмотров: 7203;
