Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ.
Классификация органических соединений. Важнейшие функциональные группы. Примеры.
По строению углеродного скелета органические соединения делятся на: а) ациклические (алифатические), в которых цепь атомов углерода может быть неразветвленной и разветвленной: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
СН3
Б) карбоциклические соединения, в составе циклов которых только атомы углерода
В) гетероциклические соединения, которые кроме атомов углерода в циклическом скелете содержат один или несколько гетероатомов (лат. гетерос – иной, другой): азот, кислород, серу
важнейшие функциональные группы:
| Функциональная группа | Название класса | Общая формула класса | |||
| формула | название | ||||
| – | – | Углеводороды | R–H | ||
| –F, –Cl, –Br, –I (–Hal) | галогены | Галогено-производные | R–Hal | ||
| –ОН | гидроксильная | Спирты Фенолы | R–OH Ar–OH | ||
| –О– | окси | Простые эфиры | R–O–R' | ||
| –SH | меркапто | Тиолы | R–SH | ||
| –NH2 | амино | Амины (первичные) | R–NH2 | ||
| – NO2 | нитро | Нитросоединения | R–NO2 | ||
| >C=O | карбонильная | Альгедиды Кетоны | R–CH=O R–CO–R' | ||
| –COOH | карбоксильная | Карбоновые кислоты | R–COOH | ||
| –SO3H | сульфо | Сульфокислоты | R–SO3H | ||
понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
Согласно теории А.М. Бутлерова, свойства и реакционная способность молекулы во многом зависят от взаимного влияния атомов или групп атомов друг на друга. Результатом взаимного влияния атомов в молекулах является перераспределение электронной плотности, что вызывает изменение реакционной способности отдельных связей и молекулы в целом. Взаимное влияние передается с помощью электронных эффектов. Различают электроноакцепторные (оттягивающие электроны – эффект « – ») и электронодонорные (посылающие электроны – эффект « + ») заместители.
Индуктивный эффект (I-эффект) – передача электронного влияния заместителей по цепи σ-связей.
Заместитель, вызвавший появление в молекуле полярной связи, способствует поляризации ближайших двух-трех σ-связей и приводит к возникновению частичных зарядов (δ) на соседних атомах. Электроноакцепторные заместители (Х), уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект (– I-эффект). Электронодонорные заместители (Y), повышающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект (+I-эффект). Графически индуктивный эффект обозначают стрелкой на конце валентной черты с острием, направленным в сторону более электроотрицательного атома. Как правило, через три-четыре связи он уже не проявляется.
Мезомерный эффект (М-эффект) – передача электронного влияния заместителей по сопряженной системе. В отличие от индуктивного, мезомерный эффект не затухает, а передается по всей сопряженной системе, т.к. р- и π-электроны более подвижны, чем σ-электроны.
Заместители, отдающие пару электронов в сопряженную систему (электронодоноры), проявляют положительный (+М-эффект) мезомерный эффект. Этот эффект характерен для заместителей, содержащих гетероатомы с неподеленной электронной парой или целым отрицательным зарядом. Заместители, являющиеся участниками сопряженной системы и содержащие кратную связь с электроотрицательным атомом, оттягивающим на себя делокализованную электронную плотность системы, проявляют отрицательный мезомерный эффект (–М-эффект). Графически М-эффект обозначают изогнутыми стрелками, начало которых показывает, какие π- или р-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются:
при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие обоих эффектов. Например, в анилине отрицательный I-эффект перекрывается более сильным +М-эффектом. За редким исключением (атомы галогенов) мезомерный эффект превалирует над индуктивным.
Классификация органических реакций (по механизму и по конечному результату). Гомолитический и гетеролитический способы разрыва связей. Электрофильные и нуклеофильные реакции. Примеры.
По конечному результату:
Реакции замещения. Их обозначают символом S (от англ. substitution). В зависимости от природы атакующего реагента замещение может быть радикальное (SR), электрофильное (SE) и нуклеофильное (SN). Замещаемая часть субстрата называется уходящей группой. При радикальном замещении уходящий свободный радикал тут же вступает в реакцию. Реакции присоединения. Их обозначают символом А (от англ. addition). Присоединение может происходить также по трем механизмам: радикальное (АR), электрофильное (AE) и нуклеофильное (AN). Реакции отщепления (элиминирования) обозначают символом Е (от англ. elimination).Чаще в этих реакциях отщепляющиеся группы уходят от соседних атомов углерода (β-элиминирование). Реакции перегруппировки. В результате процесса перегруппировок происходит переход атомов или групп от одного атома к другому. Наиболее распространен переход мигрирующей группы к соседнему атому (1,2-перегруппировка). Мигрирующая группа может переходить с одним (радикальная) или парой электронов (нуклеофильная) перегруппировка.
По механизму разрыва связей:
По этому признаку реакции подразделяют на радикальные и ионные. Радикальные реакции. При гомолитическом разрыве ковалентной связи образуются радикалы, имеющие по одному неспаренному электрону:
Примерами радикальных реагентов являются атомы галогенов Br•, Cl •, гидроксильные НО•, гидропероксильные НОО•, алкилпероксильные ROO•, алкильные R•.
Ионные реакции. При гетеролитическом разрывековалентной связи пара электронов переходит к одному из партнеров связи. При этом образуются электрофильные и нуклеофильныечастицы:
Электрофилы– частицы, образующие новые ковалентные связи за счет пары электронов партнеров (обозначаются символом Е+). Электрофильными реагентами являются: положительно заряженные ионы Н+, Br+, Cl+, NO2+, ≡C+; нейтральные молекулы, имеющие электронодефицитный центр: SO3, ≡Cδ+→X, кислоты Льюиса (FeBr3, AlCl3, BF3). Нуклеофилы– это частицы, образующие новые ковалентные связи, предоставляя партнеру пару электронов (обозначаются символами :Nu или Nu–). Нуклеофильными реагентами являются: отрицательно заряженные ионы: Br–, Cl–, HO–, HS–, RO–, RS–; нейтральные молекулы, имеющие неподеленную электронную пару гетероатома: H2O, ROH, RSH, NH3, RNH2, R2NH, R3N; доноры π-электронов: = С = С =, ароматическое кольцо.
4.классификация и изомерия спиртов и фенолов. Химические свойства спиртов: кислотно-основные, с разрывом связи R-OH, окислительно-восстановительные.
Для спиртов характерна структурная изомерия:
- изомерия положения ОН-группы - начиная с С3;
- углеродного скелета - начиная с С4;
(например, формуле C4H9OH соответствует 4 структурных изомера)
- межклассовая изомерия с простыми эфирами;
(например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3)
- Возможна пространственная изомерия - оптическая;
(например, бутанол-2 СH3"C"H(OH)СH2CH3, в молекуле которого второй атом углерода связан с четырьмя различными заместителями, существует в форме двух оптических изомеров)
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
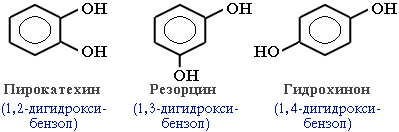
В зависимости от числа ОН-групп различают одноатомные фенолы (например,фенол и крезолы) и многоатомные. фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы)
окислительно-восстановительные реакции спиртов:1) внутримолекулярная дегадратация
2)реакция дегидрирования
первичные спирты окисляются в альдегиды, а вторичные в кетоны!!!
3)
4)
5)
Дата добавления: 2015-12-16; просмотров: 2565;
