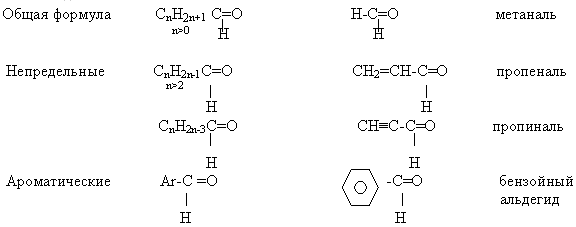
Карбонильные соединения: альдегиды, кетоны. Строение, классификация. Примеры.
альдегиды:
В зависимости от насыщенности углеводородного заместителя:
предельные (насыщенные) альдегиды (ацетальдегид);
непредельные (ненасыщенные) альдегиды (акролеин);
ароматические альдегиды (бензальдегид).
По числу карбонильных групп:
альдегиды с одной карбонильной группой (формальдегид);
диальдегиды (глиоксаль);
многоатомные альдегиды.
В зависимости от природы органических радикалов альдегиды и кетоны могут принадлежать к алифатическому или ароматическому ряду; кетоны бывают смешанными
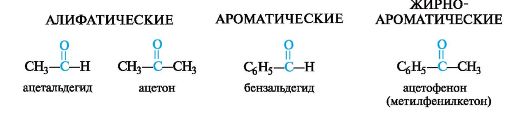
Тип гибридизации атомных орбиталей карбонильного атома углерода. Распределение электронной плотности в молекулах. Реакционные центры альдегидов и кетонов: электрофильный, основный, СН-кислотный.
• электрофильный центр - атом углерода карбонильной группы - предопределяет возможность нуклеофильной атаки;
• основный центр - атом кислорода - обусловливает возможность атаки протоном;
• СН-кислотный центр, атом водорода которого обладает слабой протонной подвижностью и может, в частности, подвергаться атаке сильным основанием.
Реакции нуклеофильного присоединения АN-типичные реакции альдегидов и кетонов. Сопоставление реакционной способности в реакциях АN: а) в гомологическом ряду альдегидов; б) в гомологическом ряду кетонов; г) кетонов и альдегидов.
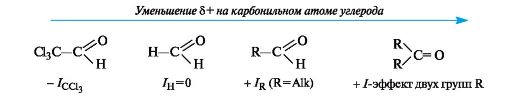
Реакции нуклеофильного присоединения АN являются наиболее характерными реакциями для карбонильных соединений. Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины частичного
положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды. С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина частичного положительного заряда δ+ на нем в альдегидах и кетонах убывает в следующем ряду:
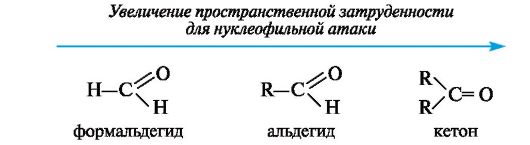
Пространственная доступность карбонильного атома углерода уменьшается при замене водорода более объемистыми органическими радикалами, поэтому альдегиды более реакционноспособны, чем кетоны. Исходя из этого, реакционная способность альдегидов и кетонов уменьшается при увеличении радикала.
Взаимодействие альдегидов а) со спиртами (образование ацеталей и полуацеталей); б) с водой; в) с аммиаком, аминами (образование иминов-оснований Шиффа); г) с циановодородной кислотой.
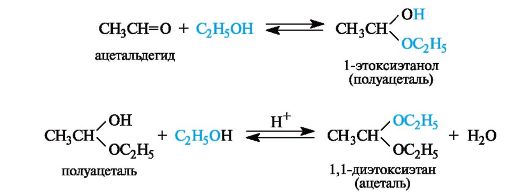
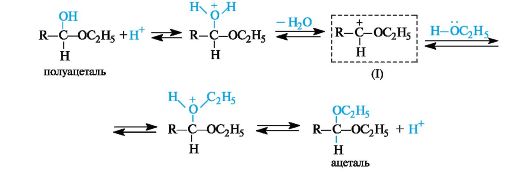
Присоединение спиртов. Спирты при взаимодействии с альдегидами легко образуют полуацетали. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали
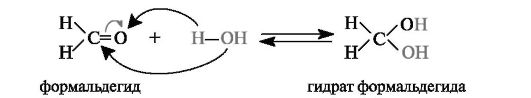
Присоединение воды. Присоединение воды к карбонильной группе - гидратация - обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата.
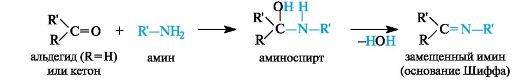
Присоединение аминов и их производных. Амины и другие азотсодержащие соединения общей формулы NH2X (X = R, NHR) реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. В связи с этим данный процесс в целом классифицируют как реакцию присоединения-отщепления.
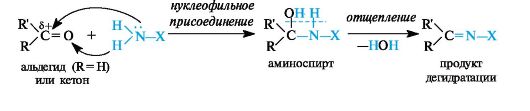
В случае первичных аминов получаются замещенные имины (их называют также основаниями Шиффа).
Дата добавления: 2015-12-16; просмотров: 3579;
