Лекция 20. Уровни энергии и спектры атомов щелочных металлов.
Спектры атомов второй группы
Группа атомов щелочных металлов – литий, натрий, калий, рубидий, цезий – непосредственно следует за благородными газами. Эти газы имеют завершенную структуру электронных оболочек, что объясняет их слабую химическую активность и высокие ионизационные потенциалы. Добавленный к такой структуре электрон в атомах щелочных металлов является как бы «лишним», поэтому он слабо связан в атоме. Это объясняет, почему щелочные металлы химически активны и обладают наименьшими потенциалами ионизации. Химические и оптические свойства атомов щелочных металлов определяются именно этим одним валентным электроном. Валентные электроны атомов щелочных металлов находятся в s–состояниях, которые характеризуются разными значениями главного квантового числа: Li – 2s, Na – 3s, K – 4s, Rb – 5s, Cs – 6s.
Может подумать, что уровни энергии атомов щелочных металлов аналогичны уровням водородоподобного атома. Это не так. В случае водородоподобного атома электрон взаимодействует с ядром по закону Кулона. В атоме щелочного металла валентный Z-й электрон находится в электрическом поле, образованном зарядом ядра Ze и остальными Z-1 электронами атома. Это электронный остов. В этом случае электрическое поле не является кулоновским, так как электронный заряд распределяется по всему объему атома. Электрическое поле электронного остова можно считать сферически симметричным, не зависящим от углов. Энергию взаимодействия валентного электрона с остовом можно представить в виде:
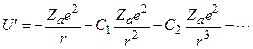 (3.41)
(3.41)
Первый член описывает энергию взаимодействия валентного электрона с положительным зарядом, сосредоточенным в центре атома, второй член – энергию взаимодействия с электрическим диполем и т.д. Этим предполагается, что распределенный по объему атома заряд остова можно представить в виде разложения по мультиполям. Каждый последующий член в (3.41) является малым по сравнению с предыдущим. Величина 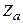 характеризует эффективный заряд электронного остова. Для щелочных металлов
характеризует эффективный заряд электронного остова. Для щелочных металлов 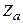 = 1, для однозарядных ионов типа
= 1, для однозарядных ионов типа 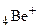 величина
величина 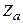 = 2, для двухзарядных ионов типа
= 2, для двухзарядных ионов типа 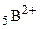
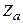 = 3, и т.д.
= 3, и т.д.
Уровни энергии атомов щелочных металлов определяются формулой:
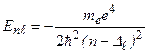 , (3.44)
, (3.44)
 где
где 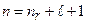 – главное квантовое число. Величина
– главное квантовое число. Величина 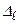 - квантовый дефект. В отличие от водородоподобного атома уровни энергии атомов щелочных металлов зависят не только от главного квантового числа, но и от орбитального квантового числа. В этом случае говорят, что происходит устранение вырожденияпо орбитальному квантовому числу. С возрастанием орбитального квантового числа роль поправки
- квантовый дефект. В отличие от водородоподобного атома уровни энергии атомов щелочных металлов зависят не только от главного квантового числа, но и от орбитального квантового числа. В этом случае говорят, что происходит устранение вырожденияпо орбитальному квантовому числу. С возрастанием орбитального квантового числа роль поправки  ослабевает. Поэтому зависимость энергии щелочного атома от числа
ослабевает. Поэтому зависимость энергии щелочного атома от числа 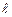 при больших его значениях практически незаметна.
при больших его значениях практически незаметна.
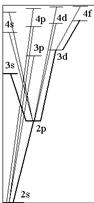
Основное состояние атома лития – 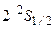 (рис.3.11). Первый возбужденный уровень –
(рис.3.11). Первый возбужденный уровень – 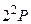 с энергией возбуждения 1,85 эВ. Устранение вырождения приводит к отличию структуры спектральных серий атома лития от серий атома водорода. В соответствии с правилами отбора возможны переходы в основное состояние со всех возбужденных р–уровней. Эти переходы вызывают
с энергией возбуждения 1,85 эВ. Устранение вырождения приводит к отличию структуры спектральных серий атома лития от серий атома водорода. В соответствии с правилами отбора возможны переходы в основное состояние со всех возбужденных р–уровней. Эти переходы вызывают
Рис.3.11 излучение, спектральные линии которого относятся к главной серии:
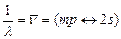 , (m = 2, 3, … ). (3.45)
, (m = 2, 3, … ). (3.45)
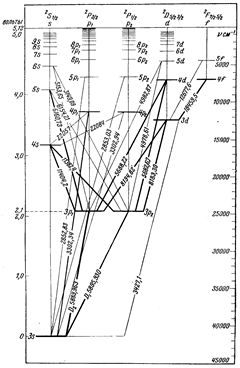 Эта серия легко наблюдается как в испускании, так и в поглощении. Другие спектральные серии связаны с разрешенными переходами между возбужденными уровнями энергии:
Эта серия легко наблюдается как в испускании, так и в поглощении. Другие спектральные серии связаны с разрешенными переходами между возбужденными уровнями энергии:
первая побочная,или диффузная серия: 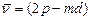 ,
,
вторая побочная,или резкая серия: 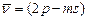 ,
,
серия Бергмана, или фундаментальная серия:
.
Линии главной серии наиболее интенсивные. Аналогичные серии характерны для всех других атомов щелочных металлов – Na, K, Rb, Cs – с учетом их основных состояний, соответственно, 3s, 4s, 5s, 6s.
Диаграмма Гротриана для атома натрия (рис.3.12). Головная линия главной серии натрия - резонансная линия. Это желтый дублет с близкими длинами волн: 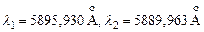 (Кирхгоф, Бунзен, 1859). Следующая за ней линия этой серии
(Кирхгоф, Бунзен, 1859). Следующая за ней линия этой серии 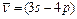 в ультрафиолете –
в ультрафиолете – 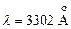 и т.д. Дублетность линий вызвана тонкой структурой p–уровней. С увеличением порядкового номера элемента тонкое расщепление состояния
и т.д. Дублетность линий вызвана тонкой структурой p–уровней. С увеличением порядкового номера элемента тонкое расщепление состояния 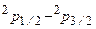 сильно возрастает.
сильно возрастает.
Рис.3.12
Атом гелия содержит два электрона. Их моменты складываются по правилу нормальной связи. Подобны атому гелия однократно ионизованный атом 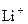 , двукратно ионизованный атом
, двукратно ионизованный атом 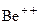 и т.д., а также атомы второй группы периодической системы элементов. В случае синглетов число S = 0, квантовое число J принимает значения:
и т.д., а также атомы второй группы периодической системы элементов. В случае синглетов число S = 0, квантовое число J принимает значения:
J = L. (3.46)
У атома гелия и ему подобных атомов синглетные состояния:
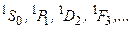 (3.46a)
(3.46a)
В случае триплетов S = 1:
J = L+1, L, L – 1. (3.46б)
Соответствующие триплетные состояния:
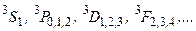 (3.46в)
(3.46в)
Решение уравнения Шредингера 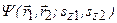 , зависящее от координат электронов и спиновых переменных, ищется в виде произведения двух функций:
, зависящее от координат электронов и спиновых переменных, ищется в виде произведения двух функций: 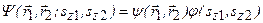 . По принципу Паули волновая функция
. По принципу Паули волновая функция 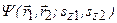 должна быть антисимметричной по всем своим переменным.
должна быть антисимметричной по всем своим переменным.
Синглетные состояния двух электронов в атоме гелия описываются симметричной координатной волновой функцией 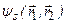 , а триплетные – антисимметричной волновой функцией
, а триплетные – антисимметричной волновой функцией 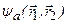 . Если считать электроны невзаимодействующими и находящимися в состояниях
. Если считать электроны невзаимодействующими и находящимися в состояниях 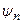 и
и 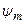 , то:
, то:
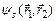 =2
=2 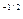
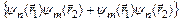 ; S = 0,
; S = 0,
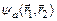 =2
=2 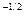
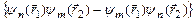 ; S = 1. (3.47а)
; S = 1. (3.47а)
Синглетные состояния атома гелия - парасостояния,триплетные – ортосостояния.Из(3.47а): основное состояние атома гелия не может быть триплетным, так как 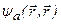 = 0. Отсюда же вытекает, что в ортосостояниях оба электрона не могут иметь одинаковые квантовые числа.
= 0. Отсюда же вытекает, что в ортосостояниях оба электрона не могут иметь одинаковые квантовые числа.
Уравнение Шредингера для многоэлектронных атомов не может быть решено точно, поэтому разработаны приближенные методы решения. Простейший из них - метод теории возмущений: вначале считается, что взаимодействием между электронами можно пренебречь. В этом случае уравнение Шредингера разбивается на два независимых уравнения для каждого электрона, так что волновая функция системы двух электронов представляется в виде произведения волновых функций отдельных электронов, а энергия системы равна сумме энергий одноэлектронных атомов 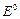 =
= 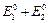 . Далее учитывается взаимодействие между электронами как возмущение. Это приводит к поправке для волновой функции и энергии системы:
. Далее учитывается взаимодействие между электронами как возмущение. Это приводит к поправке для волновой функции и энергии системы: 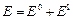 .
.
Расчеты показывают, что энергия атома гелия в пара– и орто–состояниях различна: для парасостояний энергия равна 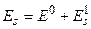 , для ортосостояний –
, для ортосостояний – 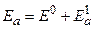 . Поправочные величины
. Поправочные величины 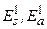 есть среднее значение энергии кулоновского взаимодействия между электронами:
есть среднее значение энергии кулоновского взаимодействия между электронами:
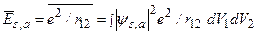 ,
,
где 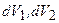 – элементы объема. Подставляя сюда (3.47а), получаем
– элементы объема. Подставляя сюда (3.47а), получаем 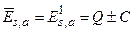 . Возможные значения энергии системы зависят от ее полного спина. Это позволяет говорить о своеобразном квантовом «обменном» взаимодействии между электронами, приводящем к такой зависимости. Величина Q представляет собой энергию классического кулоновского взаимодействия двух электронов с «размазанной» в пространстве объемной плотностью зарядов. Если объемная плотность заряда первого электрона
. Возможные значения энергии системы зависят от ее полного спина. Это позволяет говорить о своеобразном квантовом «обменном» взаимодействии между электронами, приводящем к такой зависимости. Величина Q представляет собой энергию классического кулоновского взаимодействия двух электронов с «размазанной» в пространстве объемной плотностью зарядов. Если объемная плотность заряда первого электрона 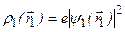 , а второго –
, а второго – 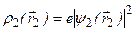 , то энергия взаимодействия этих зарядов равна
, то энергия взаимодействия этих зарядов равна 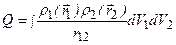 . Здесь
. Здесь 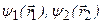 – волновые функции первого и второго электронов, соответственно. Нижние индексы у волновых функций отдельных электронов означают совокупность трех квантовых чисел (без учета спина), определяющих квантовое состояние. Величина
– волновые функции первого и второго электронов, соответственно. Нижние индексы у волновых функций отдельных электронов означают совокупность трех квантовых чисел (без учета спина), определяющих квантовое состояние. Величина 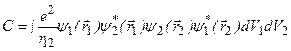 имеет чисто квантовое происхождение и называется энергией обменного взаимодействия. Она является следствием тождественности электронов – их принципиальной неразличимости, и не связана с действием особых сил.
имеет чисто квантовое происхождение и называется энергией обменного взаимодействия. Она является следствием тождественности электронов – их принципиальной неразличимости, и не связана с действием особых сил.
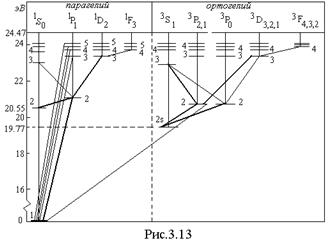 Для атома гелия существуют те же спектральные серии, что и для атомов щелочных металлов, но только в двух экземплярах, соответствующих синглетам и триплетам: две главные серии, две первых побочных, две вторых побочных серий и т.д. (рис.3.13). Характерная желтая линия
Для атома гелия существуют те же спектральные серии, что и для атомов щелочных металлов, но только в двух экземплярах, соответствующих синглетам и триплетам: две главные серии, две первых побочных, две вторых побочных серий и т.д. (рис.3.13). Характерная желтая линия 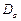 , по которой был открыт гелий (Жансен, Локьер, 1868) в спектре солнечных протуберанцев, является триплетом с длинами волн 5875,963; 5875,643 и 5875,601
, по которой был открыт гелий (Жансен, Локьер, 1868) в спектре солнечных протуберанцев, является триплетом с длинами волн 5875,963; 5875,643 и 5875,601 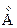 и отношением интенсивностей 1: 3: 5. Она представляет собой головной триплет первой побочной серии. Из-за очень малого различия двух последних длин волн эту линию долго считали дублетом. Главная серия триплетов находится в инфракрасной части спектра, а синглетов – в ультрафиолетовой части.
и отношением интенсивностей 1: 3: 5. Она представляет собой головной триплет первой побочной серии. Из-за очень малого различия двух последних длин волн эту линию долго считали дублетом. Главная серия триплетов находится в инфракрасной части спектра, а синглетов – в ультрафиолетовой части.
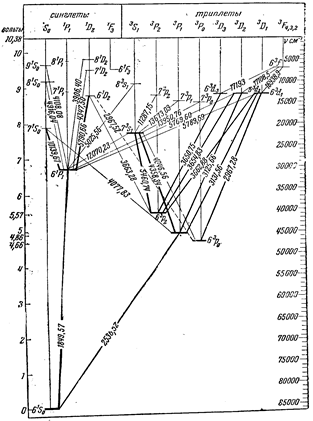 Два электрона атома гелия заполняют К–слой (электронная конфигурация –
Два электрона атома гелия заполняют К–слой (электронная конфигурация – 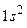 ). Основное состояние –
). Основное состояние – 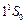 . Все остальные состояния как в синглетах, так и в триплетах являются возбужденными. Замкнутая оболочка гелия очень прочна. Поэтому его основной терм расположен намного ниже, чем у атома водорода. Потенциал ионизации гелия имеет наибольшее значение среди всех других элементов:
. Все остальные состояния как в синглетах, так и в триплетах являются возбужденными. Замкнутая оболочка гелия очень прочна. Поэтому его основной терм расположен намного ниже, чем у атома водорода. Потенциал ионизации гелия имеет наибольшее значение среди всех других элементов: 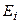 = 24,5 эВ. Состояние
= 24,5 эВ. Состояние 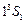 отсутствует: четверка квантовых чисел для обоих электронов совпадает:
отсутствует: четверка квантовых чисел для обоих электронов совпадает: 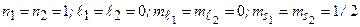 . Отсутствие терма
. Отсутствие терма 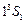 прямое следствие принципа Паули. Первое возбужденное состояние атома гелия
прямое следствие принципа Паули. Первое возбужденное состояние атома гелия 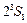 с энергией возбуждения 19,82 эВ относится к триплетам. Это состояние является метастабильным со временем жизни 7900 с. Синглетное состояние
с энергией возбуждения 19,82 эВ относится к триплетам. Это состояние является метастабильным со временем жизни 7900 с. Синглетное состояние 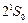 также является метастабильным. Его энергия возбуждения 20,62 эВ и время жизни 0,02 с. Нижний резонансно возбужденный уровень
также является метастабильным. Его энергия возбуждения 20,62 эВ и время жизни 0,02 с. Нижний резонансно возбужденный уровень 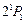 имеет энергию возбуждения 21,22 эВ и время жизни 0,56
имеет энергию возбуждения 21,22 эВ и время жизни 0,56 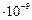 с.
с.
Атомы второй группы щелочно–земельные
Рис.3.14 металлы: Be, Mg, Ca, Sr, Ba, Ra. В эту группу
входят также: Zn, Cd, Hg. Эти элементы, как и атом гелия, имеют заполненную внешнюю s–оболочку. Их основным состоянием является 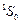 , и спектры аналогичны спектру атома гелия.
, и спектры аналогичны спектру атома гелия.
Особенности системы термов и спектра атома ртути (рис. 3.14). Основное состояние 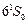 с электронной конфигурацией
с электронной конфигурацией 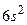 . Триплетные P–уровни с конфигурацией
. Триплетные P–уровни с конфигурацией 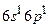 имеют энергию возбуждения 4,67 эВ, 4,89 эВ и 5,46 эВ. Согласно правилам отбора переходы с этих уровней в основное состояние невозможны. Поэтому состояния
имеют энергию возбуждения 4,67 эВ, 4,89 эВ и 5,46 эВ. Согласно правилам отбора переходы с этих уровней в основное состояние невозможны. Поэтому состояния 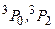 метастабильные. Вместе с тем, наблюдается достаточно интенсивная «запрещенная» линия с длиной волны
метастабильные. Вместе с тем, наблюдается достаточно интенсивная «запрещенная» линия с длиной волны 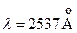 . Она возникает при интеркомбинационном переходе
. Она возникает при интеркомбинационном переходе 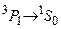 . Нижние P–уровни в триплетах имеют более низкую энергию, чем низший синглетный уровень
. Нижние P–уровни в триплетах имеют более низкую энергию, чем низший синглетный уровень 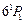 c энергией 6,78 эВ. Линия
c энергией 6,78 эВ. Линия 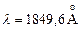 , соответствующая переходу
, соответствующая переходу 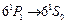 , в 30 раз интенсивнее интеркомбинационной линии. Вспомним опыты Франка и Герца. Открытый ими дискретный уровень атома ртути с энергией около 4,9 эВ соответствует возбужденному состоянию
, в 30 раз интенсивнее интеркомбинационной линии. Вспомним опыты Франка и Герца. Открытый ими дискретный уровень атома ртути с энергией около 4,9 эВ соответствует возбужденному состоянию 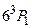 . Переход атома ртути из основного, синглетного состояния в возбужденное триплетное состояние при неупругих соударениях с электроном обусловлен изменением направления спина рассеянного электрона:
. Переход атома ртути из основного, синглетного состояния в возбужденное триплетное состояние при неупругих соударениях с электроном обусловлен изменением направления спина рассеянного электрона: 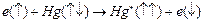 . Стрелками обозначены направления спина сталкивающегося электрона и электронов атома ртути. Звездочка означает возбужденный атом. Указанная схема отвечает сохранению полного спина системы «электрон + атом».
. Стрелками обозначены направления спина сталкивающегося электрона и электронов атома ртути. Звездочка означает возбужденный атом. Указанная схема отвечает сохранению полного спина системы «электрон + атом».
Дата добавления: 2015-12-16; просмотров: 4577;
