Типы связей электронных моментов
Состояния атома, содержащего N электронов, описываются волновой функцией 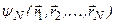 . Эта функция удовлетворяет уравнению Шредингера с оператором Гамильтона:
. Эта функция удовлетворяет уравнению Шредингера с оператором Гамильтона:
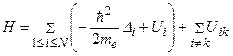 .
.
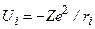 – энергия взаимодействия i - го электрона с ядром,
– энергия взаимодействия i - го электрона с ядром, 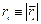 ,
,  – энергия электростатического взаимодействия между электронами. Энергия взаимодействия между электронами гораздо слабее взаимодействия каждого электрона с ядром, поэтому в нулевом приближении электростатическим взаимодействием между электронами можно пренебречь. Тогда все электроны можно считать независимыми, так что каждый из них описывается сохраняющимся орбитальным моментом
– энергия электростатического взаимодействия между электронами. Энергия взаимодействия между электронами гораздо слабее взаимодействия каждого электрона с ядром, поэтому в нулевом приближении электростатическим взаимодействием между электронами можно пренебречь. Тогда все электроны можно считать независимыми, так что каждый из них описывается сохраняющимся орбитальным моментом 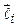 . Это значит, что сохраняется со временем длина каждого вектора
. Это значит, что сохраняется со временем длина каждого вектора 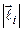 . Полный (суммарный) вектор орбитального момента импульса:
. Полный (суммарный) вектор орбитального момента импульса:
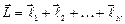 . (3.27)
. (3.27)
Из-за кулоновского взаимодействия между электронами векторы 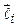 не сохраняются, но полный момент орбитального движения сохраняется, так как система изолирована. В этом случае не изменяется длина каждого вектора
не сохраняются, но полный момент орбитального движения сохраняется, так как система изолирована. В этом случае не изменяется длина каждого вектора 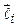 , которая определяется орбитальным квантовым числом
, которая определяется орбитальным квантовым числом 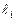 :
: 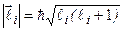 . Сохранение длин векторов
. Сохранение длин векторов 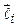 означает, что каждый из них прецессирует вокруг направления вектора
означает, что каждый из них прецессирует вокруг направления вектора 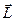 . Вектор полного орбитального момента импульса имеет длину, которая определяется квантовым числом L:
. Вектор полного орбитального момента импульса имеет длину, которая определяется квантовым числом L:
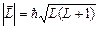 , (3.28)
, (3.28)
а также проекции на ось z:
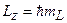 . (3.28a)
. (3.28a)
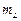 – магнитное квантовое число, пробегающее 2L+1 значений:
– магнитное квантовое число, пробегающее 2L+1 значений:
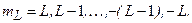 (3.28б)
(3.28б)
В случае системы двух электронов состояния характеризуется квантовыми числами 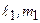 и
и 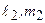 . При заданных числах
. При заданных числах 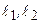 числа
числа 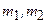 пробегают по
пробегают по 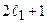 и
и 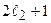 значений, соответственно, т.е. имеется всего (
значений, соответственно, т.е. имеется всего ( 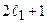 )(
)( 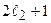 ) различных состояний. Эти состояния описываются волновыми функциями
) различных состояний. Эти состояния описываются волновыми функциями 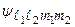 . При учете слабого кулоновского взаимодействия между электронами их состояния описываются волновыми функциями
. При учете слабого кулоновского взаимодействия между электронами их состояния описываются волновыми функциями 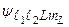 . Этих состояний при заданных числах
. Этих состояний при заданных числах 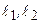 по–прежнему должно быть (
по–прежнему должно быть ( 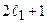 )(
)( 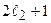 ), т.е. столько пар значений может пробегать пара чисел L,
), т.е. столько пар значений может пробегать пара чисел L, 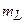 . При заданных числах
. При заданных числах 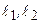 число L пробегает значения:
число L пробегает значения:
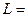
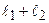 ,
, 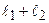 - 1,…,
- 1,…,  . (3.29)
. (3.29)
Этих значений всего 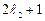 (при
(при 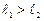 ) или
) или 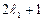 (при
(при 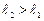 ). Полное число состояний, отвечающих данным числам
). Полное число состояний, отвечающих данным числам 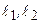 , как должно быть, равно (
, как должно быть, равно ( 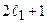 )(
)( 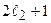 ):
):

Формула (3.29) - правило сложения моментов. Это правило универсально, не зависит от природы момента импульса.
Учтем спин электронов. Каждый из электронов обладает орбитальным моментом 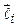 и спиновым моментом
и спиновым моментом 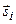 . Потенциальная энергия системы электронов складывается не только из энергии взаимодействия каждого из электронов с ядром и друг с другом, но также из спин–орбитального и спин–спинового взаимодействия. Одновременный учет всех типов взаимодействий практически невозможен. Часто электростатическое взаимодействие между электронами гораздо сильнее спин–орбитального и спин–спинового взаимодействия. В нулевом приближении ими можно пренебречь. Средняя энергия электростатического взаимодействия электронов, находящихся в поле ядра,
. Потенциальная энергия системы электронов складывается не только из энергии взаимодействия каждого из электронов с ядром и друг с другом, но также из спин–орбитального и спин–спинового взаимодействия. Одновременный учет всех типов взаимодействий практически невозможен. Часто электростатическое взаимодействие между электронами гораздо сильнее спин–орбитального и спин–спинового взаимодействия. В нулевом приближении ими можно пренебречь. Средняя энергия электростатического взаимодействия электронов, находящихся в поле ядра, 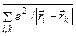 , примерно пропорциональна Z. Энергия спин–орбитального взаимодействия, пропорциональна
, примерно пропорциональна Z. Энергия спин–орбитального взаимодействия, пропорциональна 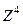 . Таким образом, пренебрежение спин–орбитальным взаимодействием вполне оправдано для достаточно легких элементов, а для тяжелых элементов преобладающим становится спин–орбитальное взаимодействие, которое превосходит спин–спиновое взаимодействие. При пренебрежении спин–орбитальным взаимодействием орбитальный и спиновый моменты каждого электрона складываются по отдельности, образуя полный орбитальный момент (3.27) и полный спиновый момент:
. Таким образом, пренебрежение спин–орбитальным взаимодействием вполне оправдано для достаточно легких элементов, а для тяжелых элементов преобладающим становится спин–орбитальное взаимодействие, которое превосходит спин–спиновое взаимодействие. При пренебрежении спин–орбитальным взаимодействием орбитальный и спиновый моменты каждого электрона складываются по отдельности, образуя полный орбитальный момент (3.27) и полный спиновый момент:
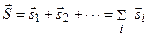 . (3.30)
. (3.30)
При учете слабого взаимодействия между спинами полный спин сохраняется, при этом векторы спина отдельных электронов прецессируют вокруг направления вектора  .
.
Полный момент импульса всех электронов 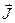 - сумма полного орбитального и полного спинового моментов:
- сумма полного орбитального и полного спинового моментов:
 . (3.31)
. (3.31)
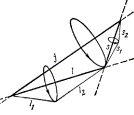 Такой тип сложения моментов отвечает нормальной связи,или связи Рассела-Саундерса(1904), или LS –связи.
Такой тип сложения моментов отвечает нормальной связи,или связи Рассела-Саундерса(1904), или LS –связи.
Для замкнутой системы вектор полного момента импульса 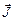 сохраняется. Векторы
сохраняется. Векторы 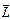 и
и 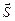 изменяются из-за спин–орбитального взаимодействия. Величины этих векторов и их проекции на направление полного момента имеют определенные значения - векторы
изменяются из-за спин–орбитального взаимодействия. Величины этих векторов и их проекции на направление полного момента имеют определенные значения - векторы 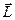 ,
,  прецессируют вокруг направления вектора
прецессируют вокруг направления вектора 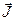 (рис.3.8).
(рис.3.8).
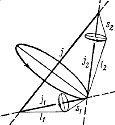 Рис.3.8 Если спин–орбитальное взаимодействие для отдельного электрона сильнее, чем взаимодействие между моментами разных электронов, то складываются орбитальный и спиновый моменты для каждого электрона и образуется его полный момент импульса:
Рис.3.8 Если спин–орбитальное взаимодействие для отдельного электрона сильнее, чем взаимодействие между моментами разных электронов, то складываются орбитальный и спиновый моменты для каждого электрона и образуется его полный момент импульса: 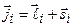 . Полный момент импульса атома - векторная сумма полных моментов отдельных электронов:
. Полный момент импульса атома - векторная сумма полных моментов отдельных электронов:
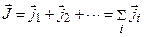 . (3.32)
. (3.32)
Векторы 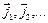 не сохраняются - прецессируют вокруг направления Рис.3.9
не сохраняются - прецессируют вокруг направления Рис.3.9
вектора полного момента импульса (рис.3.9). Такой тип сложения моментов
отвечает j–j –связи.В чистом виде этот тип связи встречается редко. Часто реализуются другие, более сложные типы связей электронных моментов
Наиболее распространенным среди атомов периодической системы элементов является нормальный тип связи. Рассмотрим его подробнее.
Полному орбитальному моменту (3.27) согласно (3.28) отвечает квантовое число L, возможные значения которого определяются правилом (3.29). Величина (длина) вектора полного спина определяется квантовым числом полного спина S:
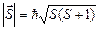 , (3.33)
, (3.33)
магнитное спиновое квантовое число 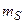 , принимает 2S+1 значений:
, принимает 2S+1 значений:
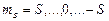 . (3.33a)
. (3.33a)
Квантовое число J полного момента импульса определяет величину (длину) вектора 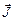 :
:
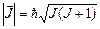 . (3.34)
. (3.34)
Проекции полного момента на ось z: 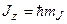 . Магнитное квантовое число
. Магнитное квантовое число 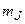 пробегает 2J+1 значений:
пробегает 2J+1 значений:
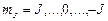 . (3.34a)
. (3.34a)
Квантовое число J определяется правилом (3.29), если известны числа L,S:
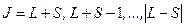 . (3.35)
. (3.35)
Число J принимает 2S+1 значений, если L 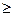 S, или 2L+1 значений, если L
S, или 2L+1 значений, если L 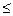 S. Квантовые числа L,S определяются в соответствии с правилом сложения (3.29). Числа L, S, J неотрицательны.
S. Квантовые числа L,S определяются в соответствии с правилом сложения (3.29). Числа L, S, J неотрицательны.
Возможные значения квантового числа полного спина. В случае двух электронов: 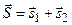 . По правилу сложения моментов (3.29):
. По правилу сложения моментов (3.29): 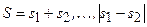 :
:
S = 1/2–1/2 = 0; S = 1/2+1/2 = 1. (3.36)
В случае трех электронов:
S = 1/2 + 1/2 + 1/2 = 3/2, S = 1/2 + 1/2 – 1/2 = 1/2.
(3.37)
В случае четырех электронов:
S = 1/2 + 1/2 + 1/2 + 1/2 = 2,
S = 1/2 + 1/2 + 1/2 – 1/2 = 1, (3.38)
S = 1/2 + 1/2 – 1/2 – 1/2 = 0.
Вспомним обозначение состояний электрона в атоме водорода. Аналогичные обозначения принимают для электронных состояний других атомов. Состоянию с данным значением числа L приписывают соответствующую букву, только не строчную, а прописную:
Значение L 0 1 2 3 4 5 6 7 8 9 10
Состояние S P D F G H I K L M N
Уровни энергии, определяемые заданными значениями чисел L и S, называются спектральными термами,или простотермами.К терму LS относятся(2L+1)(2S+1) состояний, которые различаются значениями проекций орбитального и спинового моментов на ось z. Учет спина и релятивистских эффектов приводит к расщеплению терма LS наряд компонент, соответствующих значениям полного момента J. Это – тонкое, или мультиплетное расщепление.В этом случае используется следующее обозначение состояния: справа от буквы, обозначающей состояние, внизу пишут значение числа J, а слева вверху – мультиплетность2S + 1, т.е. общее число значений, которое принимает квантовое число J (при L 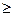 S):
S): 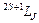 . Например, символ
. Например, символ 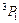 означает, что числа L = 1, J = 1, S = 1. Читают так: «триплет P единица». При L
означает, что числа L = 1, J = 1, S = 1. Читают так: «триплет P единица». При L 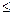 S число компонент равно 2L+1. Таким образом, энергия атома определяется числами L,S,J и не зависит от квантового числа
S число компонент равно 2L+1. Таким образом, энергия атома определяется числами L,S,J и не зависит от квантового числа 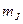 , принимающего 2J+1 значение. Это значит, что каждый уровень энергии имеет кратность вырождения 2J+1.
, принимающего 2J+1 значение. Это значит, что каждый уровень энергии имеет кратность вырождения 2J+1.
Мультиплетность состояний (и термов) определяется спиновым квантовым числом как 2S+1 (при L 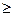 S). Возможные значения числа S зависят от количества электронов согласно (3.36) -(3.38). В случае одного электрона термы являются дублетами. В случае двух электронов число S = 0 или 1. Тогда мультиплетность равна: 2·0 + 1 = 1, или 2·1+1 = 3. Состояния с мультиплетностью 1 называют синглетами, а с мультиплетностью 3 – триплетами. В случае трех электронов число S = 1/2 или 3/2. Тогда состояния являются дублетамии квартетами.В случае четырех электронов S = 0, 1, 2. Состояния атомов являются синглетами, триплетами и квинтетами.Аналогично определяется мультиплетность в случае большего числа электронов.
S). Возможные значения числа S зависят от количества электронов согласно (3.36) -(3.38). В случае одного электрона термы являются дублетами. В случае двух электронов число S = 0 или 1. Тогда мультиплетность равна: 2·0 + 1 = 1, или 2·1+1 = 3. Состояния с мультиплетностью 1 называют синглетами, а с мультиплетностью 3 – триплетами. В случае трех электронов число S = 1/2 или 3/2. Тогда состояния являются дублетамии квартетами.В случае четырех электронов S = 0, 1, 2. Состояния атомов являются синглетами, триплетами и квинтетами.Аналогично определяется мультиплетность в случае большего числа электронов.
Возможные радиационные переходы между различными состояниями атома 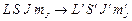 определяются правилами отбора. При излучении или поглощении фотона в системе «атом + фотон» выполняется закон сохранения момента импульса:
определяются правилами отбора. При излучении или поглощении фотона в системе «атом + фотон» выполняется закон сохранения момента импульса:
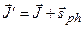 , (3.39)
, (3.39)
где 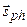 – собственный механический момент импульса (спин) фотона. Отсюда в дипольном приближении следуют правила отбора для квантового числа J:
– собственный механический момент импульса (спин) фотона. Отсюда в дипольном приближении следуют правила отбора для квантового числа J:
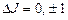 . (3.40)
. (3.40)
При этом переход 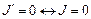 cтрого запрещен (Ланде, 1921). Чтобы учесть запрещение таких переходов, правило (3.40) дополняют условием:
cтрого запрещен (Ланде, 1921). Чтобы учесть запрещение таких переходов, правило (3.40) дополняют условием: 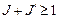 .
.
Для спинового квантового числа существует правило отбора:
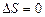 . (3.40a)
. (3.40a)
Поскольку число S определяет мультиплетность термов (и состояний), то правило (3.40а) означает, что переходы между состояниями с различной мультиплетностью запрещены. Это - принцип запрета интеркомбинаций.
Дата добавления: 2015-12-16; просмотров: 1175;
