Развитие теоретических воззрений от времени А. М. Бутлерова до наших дней.
А. М. Бутлеров не сомневался, что построенная из реально существующих атомов молекула должна представлять собой определенное физическое тело в трехмерном пространстве.
Конкретную идею о пространственном стереохимическом строении органических соединений выдвинул в 1874 году Я. Г. Вант – Гофф. Идея Я. Г. Вант – Гоффа заключалась в том, что четыре заместителя расположены симметрично в углах воображаемого тетраэдра вокруг четырехвалентного атома углерода. Простейшим примером может быть молекула метана.
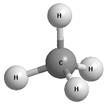
Это представление Я. Г. Вант – Гоффа первоначально было не более чем гипотезой. Последующее развитие науки дало этой гипотезе прочную физическую основу: с помощью методов рентгенографии и электронографии стали определять межатомные расстояния и валентные углы, то есть получать реальную картину расположения атомов в молекуле. Все получаемые таким образом данные находятся в соответствии с теорией химического строения и дополняющими ее стереохимическими представлениями.
В связи с научной революцией в физике в конце XIX – в начале XX века атом предстал перед исследователями сложной системой, в которой большую роль играют электрические силы. Эти успехи физики позволили подойти к решению коренной проблемы – природы валентности. В 1911 году Э. Резерфорд предложил планетарную модель атома, а через два года Н. Бор дал математическую обработку этой модели. На основе этой модели в 1916 году В. Коссель выдвинул предположение, что при образовании химической связи происходит передача электронов от одного атома к другому, возникают противоположено заряженные частицы (катионы и анионы), которые притягиваются друг к другу. Так получила объяснение ионная связь, характерная для неорганических соединений. Но данное объяснение не подходит для таких молекул, как водород, хлор, метан, и вообще для всех органических соединений. Химическая связь имеющегося здесь типа получила название ковалентной связи. Основы для ее понимания заложили в 1913 – 1920 годах Г. Льюис и И. Лонгмюр, указавшие на особую роль восьмиэлектронной группировки (октета электронов) и на возможность создания устойчивого октета не только путем передачи, но и путем обобществления электронов. На основе этих представлений валентная черточка классической теории строения получила физическое истолкование: она оказалась парой электронов.
Дата добавления: 2015-11-06; просмотров: 1218;
