Составление названия органического вещества.
Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь:
| Число атомов углерода | С1 | С2 | С3 | С4 | С5 | С6 | С7 | С8 | С9 |
| Корень слова | МЕТ- | ЭТ- | ПРОП- | БУТ- | ПЕНТ- | ГЕКС- | ГЕПТ- | ОКТ- | НОН |
Затем следует суффикс, характеризующий степень насыщенности:
| Степень насыщенности | Одинарная связь (С-С) | Двойная связь (С=С) | Тройная связь (С≡С) |
| Суффикс | -ан | -ен | -ин |
Если кратных связей в молекуле несколько, то в суффиксе указывается число таких связей, например: -диен, -триен, а после суффикса обязательно арабскими цифрами указывается положение кратной связи (например, бутен-2, бутадиен-1,3).
В суффикс выносится название самой старшей характеристической группы в молекуле с указанием ее положения цифрой.
Заместители обозначаются с помощью приставок. Они перечисляются в алфавитном порядке. Положение заместителя указывается цифрой перед приставкой. Название заместителя образуется из корня и суффикса –ил. Если в молекуле несколько одинаковых заместителей, то перед названием соответствующей группы словом указывается их количество:
| Количество одинаковых заместителей | Два | Три | Четыре | Пять | Шесть | Семь | Восемь |
| Слово-числительное | Ди | Три | Тетра | Пента | Гекса | Гепта | Окта |
Все цифры в названиях молекул отделяются от слов дефисом, а друг от друга запятыми.
Пример.
Назовем следующее соединение.
5 4 3 2 1
СН2=СН-СН2-СН(ОН)-СН3
Выбор цепи однозначен, следовательно, корень слова – пент; далее следует суффикс – ен, указывающий на наличие кратной связи;
Порядок нумерации обеспечивает старшей характеристической группе (-ОН) наименьший номер;
Полное название соединения заканчивается суффиксом, обозначающим старшую группу (в данном случае суффикс –ол указывает на наличие гидроксильной группы); положение двойной связи и гидроксильной группы указывается цифрами.
Следовательно, приведенное соединение называется пентен-4-ол-2.
Тема № 1. Общие вопросы органической химии. Теория химического строения органических веществ. Электронная природа химических связей.
1.Теория химического строения органических веществ А.М. Бутлерова.
Доструктурные теории.
Теория радикалов.
Еще в XVIII столетии ученые заметили, что существуют определенные сочетания атомов, как бы переходящие в неизменном виде из одного соединения в другое. Примером может служить группа циана CN, которая входит в состав многих солей (KCN, K3Fe(CN)6 и другие), играя роль в них аниона. Эта группа может входить в состав органических соединений.
В 30 – х годах XIX века Ю. Либих и Ф. Велер, исследуя химические превращения жидкости, выделенной из масла горького миндаля, установили, что из нее можно получить целый ряд соединений, в состав которых входит группа атомов C7H5O, названная ими бензоилом: C7H5OH – водородистый бензоил, C7H5OCl – хлористый бензоил, C7H5O *ОН – «гидрат окиси бензоила» (бензойная кислота).
Факты подобного рода послужили основой для создания теории радикалов, развитой И. Берцелиусом. Теорию радикалов называют дуалистической (от греческого «дуалис» - два, двойственный), поскольку она подходила к органическому веществу как комбинации двух частей – органического радикала и простого неорганического (обычно кислородсодержащего) остатка. Неорганический остаток И. Берцелиус считал электроотрицательной частью, органический радикал – положительной частью, проводя, таким образом, аналогию с неорганическими соединениями. Органическую химию И. Берцелиус определял как «химию сложных радикалов», считая их «подлинными элементами органической химии».
Теория радикалов правильно отмечала одну из особенностей органических веществ – существование устойчивых группировок атомов - радикалов, переходящих в неизменном виде из одного соединения в другое. Ошибочным в данной теории было представление, что органические радикалы абсолютно неизменны и могут существовать сами по себе, подобно простым веществам неорганической природы. Упрощенными были и представления об электрической полярности отдельных частей органической молекулы.
Теория радикалов не могла полностью объяснить реакции замещения в органической химии, при которых хлор (элемент, обладающий высокой электроотрицательностью) занимает в органических соединениях место электроположительного водорода, входящего в состав радикала, а свойства при этом практически не менялись.
Теория типов.
В 40- х годах XIX века О. Лоран и Ш. Жерар предложили теорию типов. Все органические соединения по теории типов считали производными простейших неорганических веществ – водорода, хлороводорода, воды, аммиака:
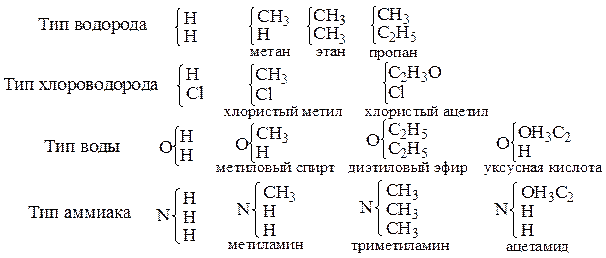
Классификация органических соединений по теории типов, как и употреблявшиеся типические формулы конкретных соединений (см схему выше), близки современным. Однако по теории типов формулы органических соединений выражают не внутреннее строение молекул, а лишь способы образования и реакции вещества. Ш. Жерар прямо говорил с этим, что химическая формула – это только краткая запись его реакций. Теория типов допускала множество рациональных типов для одного и того же вещества в зависимости от того, какие реакции хотели этими формулами выразить.
Постепенно, после долгих споров теория типов сменила теорию радикалов.
Важным этапом развития химии явилось создание понятия о валентности. Эта заслуга принадлежит Э. Франкленду. Свои выводы о валентности целого ряда элементов он сделал на основании изучения металлоорганических соединений, таких как цинкдиметил Zn(CH3)2, триэтилсурьма Sb(C2H5)3. цинк в этом соединении двухвалентен, а сурьма трехвалентна.
Развивая учение о валентности, А. Кекуле в 1858 году разработал представление о четырехвалентности углерода. А. Кекуле стал разбивать изображаемые в типических формулах остатки на еще более мелкие группировки, выводимые в конечном итоге из простейшего органического вещества – метана.
В 1858 году А. Купер обратил внимание на то, что атомы углерода в органических соединениях могут затрачивать свою валентность не только на связь с иными элементами, но и друг с другом. А. Купер одновременно с А. Кекуле указал на способность углерода образовывать цепи.
Однако по вопросу о значении формул как А. Кекуле, так и А. Купер целиком оставались на позиции теории типов.
Дата добавления: 2015-11-06; просмотров: 1992;
