Краткая история возникновения органической химии и ее развитие.
Органическая химия – это раздел химической науки, в котором изучаются соединения углерода – их строение, свойства, способы получения и практического использования.
Соединения, в состав которых входит углерод, называются органическими.
Кроме углерода, они почти всегда содержат водород, довольно часто – кислород, азот и галогены, реже – фосфор, серу и другие элементы. Однако сам углерод и некоторые простейшие его соединения, такие как оксид углерода (II), оксид углерода (IV), угольная кислота, карбонаты, карбиды и т.п., по характеру свойств относятся к неорганическим соединениям. Поэтому часто используется и другое определение:
Органические соединения – это углеводороды (соединения углерода с водородом) и их производные.
Благодаря особым свойствам элемента углерода, органические соединения очень многочисленны. Сейчас известно свыше 20 миллионов синтетических и природных органических веществ, и их число постоянно возрастает.
В истории развития органической химии просматривается несколько периодов.
Эмпирический период. Время от первоначального знакомства человека с органическими веществами до становления органической химии как науки (конец XVIII – начало XIX в.). Основным итогом данного периода явилось осознание значения элементарного анализа и установление молекулярной массы как подхода к молекулярным формулам. В этот период господствовало учение, получившее название «витализм» (от лат. vita – жизнь). Виталисты полагали, что органические вещества могут образовываться только в живой материи под действием «жизненной силы». Витализм поддерживался шведским ученым Я. Берцелиусом. Витализм тормозил развитие органической химии, так как по существу признавал органический мир непознаваемым.
Аналитический период. С конца первой четверти XIX в. Начинается активный синтез органических веществ из неорганических. Большой вклад в синтез органических веществ внес Ф. Велер. 1824 г. – синтезировал щавелевую кислоту из дициана (C2N2), в 1828 г. – мочевину из циановокислого аммония (NH4CNO), в 1862 г. – ацетилен из карбида кальция. В 1861 г. А.М. Бутлеров осуществил синтез сахаристого вещества из формальдегида. Появились методы определения состава органических веществ. Аналитический период нанес удар по витализму и постепенно его вытеснил. Было выяснено, что органические вещества отличаются от неорганических прежде всего по составу. Было доказано, что органические вещества можно синтезировать, не используя «жизненную силу».
Структурный период. Конец XIX – начало XX в. Период имеет важное значение в истории и развитии органической химии. Этот период отмечен рождением научной теории химического строения органических веществ
(1861 г.), основоположником которой явился русский химик А.М. Бутлеров. Отличительными чертами структурного периода явились широкий синтез и определение структуры множества органических соединений с помощью химических, а позднее (с конца XIX – начала XX в.) и с привлечением физических и физико-химических методов анализа. В XXI веке в эти процессы активно внедряются автоматика и компьютерная техника.
Углерод.
Выделение органической химии в самостоятельную науку обусловлено большим числом и многообразием соединений углерода, а так же специфическими свойствами органических соединений
Углерод. Символ «С», элемент IVA группы 2-го периода Периодической системы элементов; атомный номер 6; атомная масса 12,01115. Электронная конфигурация в основном состоянии 1s22s22p2. Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные).
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
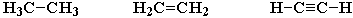
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
фактор 1. наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен, ни терять, ни приобретать свободные электроны с образованием ионов);
фактор 2. малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные связи, а не ионные связи, и проявляет валентность, равную 4.
Дата добавления: 2015-11-06; просмотров: 18716;
