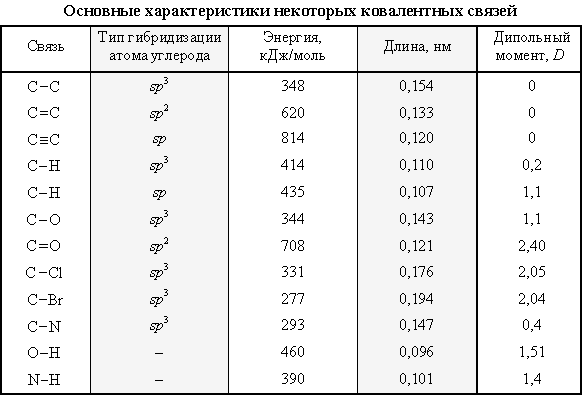
Характеристики ковалентной связи.
Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
1) Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
2) Длина связи - расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
3) Дипольный момент связи (m) – векторная величина, характеризующая полярность связи.
Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = l×q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы. На характеристики связей влияет их кратность:
энергия связи увеличивается в ряду: 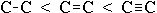 ;
;
длина связи растет в обратном порядке: 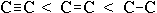 .
.
2.2.2.3. Неполярная ковалентная связь.
Неполярная (симметричная) ковалентная связь - связь между атомами с практически равной электроотрицательностью (0,4 > Dc = 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов.
Например: H-H, F-F, Cl-Cl, C-C.
Дипольный момент таких связей равен 0.
Связь С-Н в предельных углеводородах (например, в СН4) считается практически неполярной, т.к. Dc = 2.5(С) - 2.1(Н) = 0,4.
Следует отметить, что в непредельных углеводородах 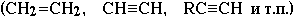 электроотрицательность углерода выше и связь С-Н более полярна (особенно, если атом Н связан с углеродом, имеющим тройную связь:
электроотрицательность углерода выше и связь С-Н более полярна (особенно, если атом Н связан с углеродом, имеющим тройную связь: 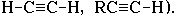
Дата добавления: 2015-11-06; просмотров: 1628;
