Sp-Гибридизация (линейная).
Одна s- и одна р-орбиталь смешиваются, образуя две равноценные sp-орбитали, расположенные под углом 180°, т.е. на одной оси.

Гибридные sp-орбитали участвуют в образовании двух s-связей. Две р-орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях:
p-Орбитали образуют в соединениях две p-связи. Для элементов 2-го периода sp-гибридизация происходит по схеме:
2s + 2px= 2 (2sp) 2py- и 2pz-АО не изменяются.
Схема sp-гибридизации
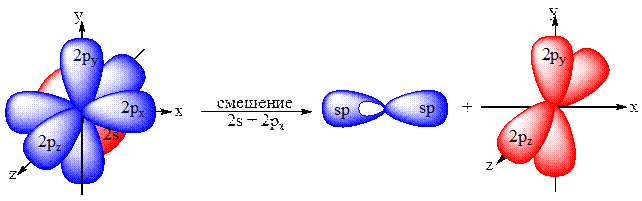
Для простоты изображения пространственного строения sp-атома обычно рисуют р-орбитали в форме электронных облаков, а гибридные орбитали изображают прямыми линиями:
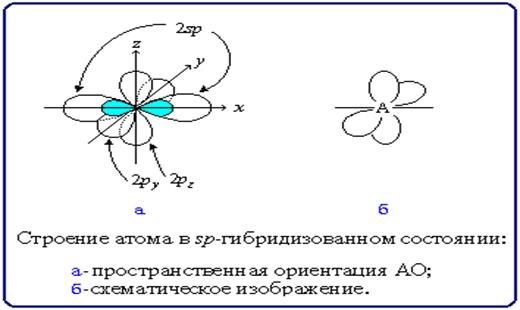
Например, sp-атом углерода. Строение молекул с sp-атомами отражают их модели:
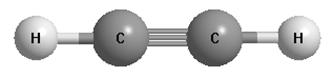
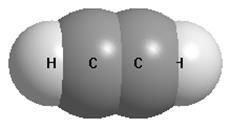
Модели молекул ацетилена
sp-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 2
Углерод в sp-гибридном состоянии присутствует:
в соединениях с тройной связью 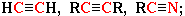
в соединениях типа R2C=C=CR2;
в простом веществе - карбине, cтроение которого представляют формулами: 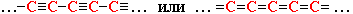
Дата добавления: 2015-11-06; просмотров: 1992;
