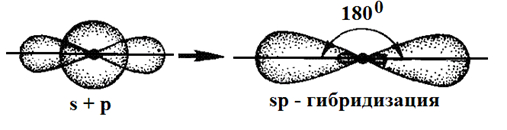
Sp-гибридизация
Рассмотрим на примере гидрида бериллия ВеН2. Электронное строение атома Ве в нормальном состоянии 1s22s2. Атом бериллия может вступать во взаимодействие с атомами водородом только в возбужденном состоянии (s ® р-переход).
Ве – 1s22s12p1
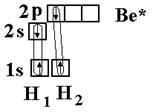
Две образующиеся связи должны быть различны по энергии, так как возникновение одной связано с перекрыванием двух s-орбиталей, вто-
рой – s- и p-орбиталей. Тогда и атомы водорода в молекуле должны быть химически неравноценны: один более подвижен и реакционноспособен, чем другой. Экспериментально это не так – оба атома водорода энергетически равноценны. Для объяснения этого явления Дж.К. Слейтер и Л. Полинг предположили, что «при интерпретации и расчете углов между связями и длины связи целесообразно близкие по энергии связи заменить равным количеством энергетически равноценных связей». Возникающие подобным образом связи являются гибридными.
Таким образом, одна s- и одна р-орбиталь атома бериллия заменяются двумя энергетически равноценными sp-орбиталями, располагающимися под углом 180о друг к друг, т.е. молекула имеет линейное строение.
Дата добавления: 2015-10-21; просмотров: 1778;
