Характеристики ковалентной связи
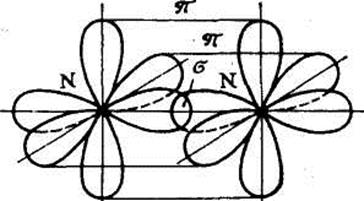
1. Пространственная направленность. Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов, такая связь называется s-связью (s–s-перекрывание Н2, р–рCl2, s–рHC1).
При перекрывании p-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Такая ковалентная связь называется p-связью. Например, в молекуле азота атомы связаны одной s-связью и двумя p-связями.
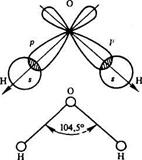
Направленность связи определяет пространственную структуру молекул, т. е. их форму и характеризуется наличием строго определенного угла между связями. Например, угол между s-связями в молекуле воды равен 104,5°.
2. Полярность связи определяется асимметрией в распределении общего электронного облака вдоль оси связи.
Если общие электронные пары располагаются симметрично относительно обоих ядер, то такая ковалентная связь называется неполярной.
Если общие электронные пары смещаются к одному из атомов (располагаются несимметрично относительно ядер различных атомов), то такая ковалентная связь называется полярной.
В случае, когда электронная пара смещается в сторону более электроотрицательного атома центры (+) и (–) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов, расстояние между которыми (l) называют длиной диполя. Мерой полярности молекул является электрический момент диполя m, равный произведению абсолютного значения заряда электрона
(q = 1,6 × 10–19 Кл) на длину диполя l:
m = q×l.
Единицей измерения m является дебай D, 1 D = 3,33×10–30 Кл×м.
Задание.Длина диполя молекулы HCl равна 2,2×10–9 см. Вычислить электрический момент диполя.
2,2×10–9 см = 2,2×10–11 м
m = 1,6 × 10–19 ×2,2×10–11 = 3,52×10–30 Кл×м = 3,52×10–30/3,33×10–30 = 1,06 D.
3. Кратность ковалентной связи определяется числом общих электронных пар, которые связывают атомы. Связь между двумя атомами при помощи одной пары электронов называется простой (связи Н – С1, С – Н, Н – О и т. д.). Связь при помощи двух электронных пар называется двойной (этилен Н2С = СН2), при помощи трех электронных пар – тройной (азот N 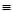 N, ацетилен Н – С
N, ацетилен Н – С 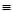 С – Н).
С – Н).
4. Длина связи – это равновесное расстояние между ядрами атомов. Длину связи выражают в нанометрах (нм). 1 нм = 10–9 м. Чем меньше длина связи, тем прочнее химическая связь.
5. Энергия связи равна работе, которую необходимо затратить на разрыв связи. Выражают энергию связи в килоджоулях на моль (кДж/моль). Энергия связи увеличивается с уменьшением длины связи и с увеличением кратности связи. Процесс образования связи протекает с выделением энергии (экзотермический процесс), а процесс разрыва связи – с поглощением энергии (эндотермический процесс).
Дата добавления: 2015-10-21; просмотров: 815;
