Sp3-гибридизация
Рассмотрим на примере метана СН4. В нормальном состоянии атом углерода с электронным строением 1s22s22p2 может дать только две ковалентные связи. В возбужденном состоянии он способен быть четырехвалентным с электронным строением 1s22s12р3.
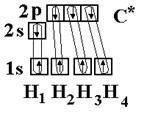
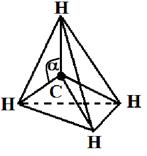
Гибридными становятся одна s- и три р-орбитали атома углерода, при этом образуются четыре sp3-гибридные, энергетически равноценные орбитали. Молекула метана приобретает тетраэдрическое строение. В центре тетраэдра, все вершины которого геометрически равноценны, находится атом углерода, а в его вершинах атомы водорода. Угол между связями составляет 109о28¢.
Силы взаимодействия между молекулами называют ван-дер-ваальсовыми или межмолекулярными. Это взаимодействие обусловлено электростатическим притяжением между отдельными молекулами и характеризуется следующими особенностями:
- действует на сравнительно больших расстояниях, существенно превосходящих размеры самих молекул;
- характеризуется малой энергией, поэтому существенно ослабевает с повышением температуры;
- является ненасыщающимся, т. е. взаимодействие данной молекулы со второй не исключает подобного эффекта по отношению к третьей, четвертой и т. д.
С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ.
Дата добавления: 2015-10-21; просмотров: 2710;
