Ковалентная связь
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Ковалентная связь бывает двух типов: неполярная и полярная.
Неполярная связь возникает между атомами неметалла одного химического элемента, т.е. атомами с одинаковой электроотрицательностью (O2, N2, Cl2).
Рассмотрим образование молекулы водорода Н2. Электронная конфигурация атома водорода 1s1, т. е. на внешнем электронном слое (он единственный) находится один неспаренный электрон. При образовании молекулы водорода из двух атомов, имеющих непарные s-электроны с антипараллельными спинами, происходит перекрывание s-орбиталей и образуется общая электронная пара (рис. 4а).

Рис. 4. Перекрывание: а - s-орбиталей; б- s- и р-орбиталей;
в - р-орбиталей.
 |
Схематически это можно изобразить с помощью электронных формул:
Н··+ ·Н ® Н : Н
Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
Н–Н
Общая электронная пара одинаково принадлежит обоим атомам, каждый атом получает устойчивую оболочку из двух электронов. Наибольшая электронная плотность общего электронного облака проявляется в области между ядрами. Молекула водорода образуется за счет взаимодействия общей электронной пары с ядрами обоих атомов.
Задание. Изобразить схему образования молекулы хлороводорода.
Cl 1s22s22p63s23p5; Н 1s1
Общая электронная пара смещается к атому с большей электроотрицательностью. ЭО (Cl) = 2,83 эВ, ЭО(Н) = 2,1 эВ.
Н··+ · 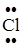 : ®
: ® 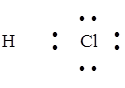
H–Cl
Электронная пара смещена к атому хлора, т.к. ЭО(Cl) > ЭО(Н).
Дата добавления: 2015-10-21; просмотров: 858;
