Форма молекулярных орбиталей. s- и p-МО.
Форма молекулярных орбиталей определяется геометрией перекрывания атомных орбиталей.
Возможны два типа перекрывания атомных орбиталей:
осевое или s (сигма)-перекрывание;
боковое или p (пи)-перекрывание.
По типу перекрывания исходных АО образующиеся молекулярные орбитали относят к s-МО или p-МО.
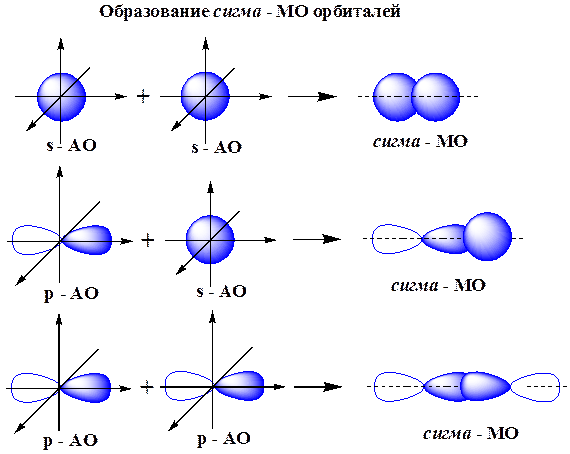
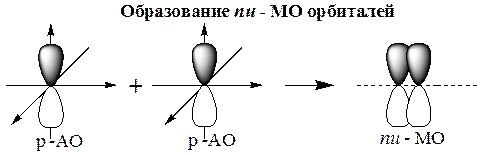
s-МО образуются при осевом перекрывании s-, p- и гибридных АО, которое происходит вдоль оси, соединяющей ядра атомов.
p-МО возникают при боковом перекрывании лопастей р-орбиталей, ориентированных параллельно друг к другу. Таким образом, p-перекрывание происходит вне линии, соединяющей ядра атомов. Оно не характерно для s- и гибридных АО.
Молекулярные орбитали s- и p- типа могут быть связывающими, разрыхляющими и несвязывающими.
S-, p-Связи.
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО - s-МО или p-МО - образующиеся связи относят к s- или p-типу.
s-Связь - ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов.
p-Связь - ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
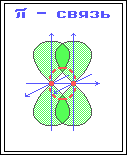
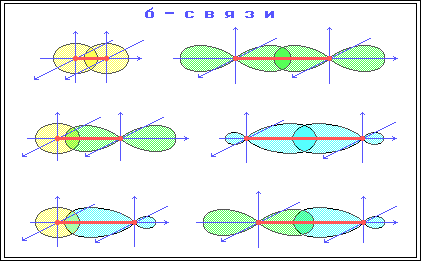
p-Связи образуются между атомами, уже соединенными s-связью. Эта связь слабее s-связи из-за менее полного перекрывания р-АО.
Различное строение s- и p-молекулярных орбиталей определяет характерные особенностиs- и p-связей.
s-Связь прочнее p-связи. Это обусловлено более эффективным перекрыванием АО при образовании s-МО и нахождением s-электронов между ядрами.
По s-связям возможно внутримолекулярное вращение атомов, т.к. форма s-МО допускает такое вращение без разрыва связи.
Вращение по p-связи невозможно без ее разрыва.
Электроны на p-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с s-электронами. Поэтому поляризуемость p-связи значительно выше, чем s-связи.
Дата добавления: 2015-11-06; просмотров: 2770;
