Властивості твердих тіл. Деформації
Тема 6: Властивості газів, рідин, твердих тіл
План
Взаємодія атомів і молекул у газах, рідинах і твердих тілах
Властивості пари. Пароутворення (випаровування та кипіння). Конденсація. Вологість повітря та її вимірювання
Основні властивості рідини
Властивості твердих тіл. Деформації
1.Молекули різних речовин взаємодіють силами притягання і відштовхування, що мають електромагнітну природу. Модулі цих сил залежать від відстані між молекулами. Тому потенціальна енергія W, що характеризує інтенсивність таких взаємодій, також залежить від відстані між молекулами (рис. 1).
 Значення потенціальної енергії в точці мінімуму – від’ємне, а сили притягання та відштовхування, якщо r = r0, взаємно компенсовані. Унаслідок зменшення відстані між молекулами 1 і 2 (r < r0) завдяки зростанню сили відштовхування потенціальна енергія швидко збільшується, стаючи додатною. За міжмолекулярних відстаней r > r0 потенціальна енергія зростає, залишаючись від’ємною: сили притягання при цьому переважають над силами відштовхування. Коли відстань між молекулами буде в декілька разів більшою за r0, то потенціальна енергія, залишаючись від’ємною, стає малою і прямує до нуля. Рис. 1
Значення потенціальної енергії в точці мінімуму – від’ємне, а сили притягання та відштовхування, якщо r = r0, взаємно компенсовані. Унаслідок зменшення відстані між молекулами 1 і 2 (r < r0) завдяки зростанню сили відштовхування потенціальна енергія швидко збільшується, стаючи додатною. За міжмолекулярних відстаней r > r0 потенціальна енергія зростає, залишаючись від’ємною: сили притягання при цьому переважають над силами відштовхування. Коли відстань між молекулами буде в декілька разів більшою за r0, то потенціальна енергія, залишаючись від’ємною, стає малою і прямує до нуля. Рис. 1
У газоподібному стані середня відстань між молекулами набагато більша від r0, тому сили міжмолекулярних взаємодій суттєво не впливають на рух молекул. Кінетична енергія руху молекул газу значно більша від потенціальної енергії їх взаємодії. Молекули газу рухаються хаотично (в довільних напрямах і з довільною швидкістю). Молекула, що складається з декількох атомів, під час свого поступального руху буде ще й обертатися.
У твердому стані відстані між молекулами (атомами) майже дорівнюють r0. Через значні міжатомні взаємодії атоми в твердих тілах здійснюють лише коливальний рух відносно положень рівноваги (у кристалах відносно вузлів кристалічних ґрат). Тому потенціальна енергія взаємодії молекул значно більша від їх кінетичної енергії.
У рідинах сили взаємодії між молекулами слабкіші, ніж у твердих тілах і значно сильніші, ніж у газах. Молекула рідини, коливаючись біля певного положення рівноваги, змінює з часом це положення, перескакуючи до інших молекул. Молекули рідини здійснюють коливальний, поступальний і обертальний рухи. У рідинах відстані між молекулами сумірні з їх ефективним діаметром, тому сили взаємодії молекул є значними. У цілому кінетична енергія молекул рідин приблизно дорівнює їх потенціальній енергії.
Отже, молекули рідини знаходяться в неперервному хаотичному русі. Якщо молекула випадково з’являється біля поверхні внаслідок підштовхування знизу іншою, то вона може набути швидкості, достатньої для подолання притягання з боку інших молекул і вийти в простір над рідиною. Сукупність молекул, що знаходяться в цьому просторі, називають парою, а процес переходу рідини в стан пари – пароутворенням.
2. Пароутворення з вільної поверхні рідини називають випаровуванням. Молекули пари, рухаючись хаотично, можуть набути швидкості, напрямленої, наприклад, в бік рідини, і до неї повернутись. Процес переходу молекул пари в рідину називають конденсацією. Оскільки з рідини під час випаровування вилітають найшвидші молекули, то середня швидкість тих молекул, що залишились, зменшується, тому під час випаровування рідина охолоджується. Для підтримання температури такої рідини сталою необхідно підводити тепло. Унаслідок конденсації затрачене для випаровування тепло повертається.
У міру збільшення температури рідини інтенсивність випаровування збільшується. Випаровування відбувається за будь-якої температури. Особливим видом випаровування є процес кипіння.
 Кипіння – процес утворення пари не тільки на поверхні рідини, а і в її об’ємі. У рідині завжди містяться бульбашки розчиненого в ній газу, вони заповнені насиченою парою. За звичайної температури тиск насиченої пари бульбашок набагато менший від зовнішнього тиску, тому ці бульбашки сплюснуті і мають мікроскопічні розміри. З підвищенням температури тиск насиченої пари в бульбашці зростає. За деякої граничної температури для кожної рідини, яку називають температурою кипіння, тиск пари всередині бульбашок переважає зовнішній, внаслідок чого бульбашки збільшуються в об’ємі і під дією сили Архімеда спливають на поверхню та лопаються (рис. 2). На місці цих бульбашок утворюються інші, і вся рідина закипає. Чим більший зовнішній тиск, тим вищою буде температура кипіння і навпаки. Кожна рідина має свою температуру кипіння, яка залежить від тиску насиченої пари. Чим більший тиск насиченої пари, тим менша температура кипіння. Чим менший тиск насиченої пари, тим більша температура кипіння. Рис. 2
Кипіння – процес утворення пари не тільки на поверхні рідини, а і в її об’ємі. У рідині завжди містяться бульбашки розчиненого в ній газу, вони заповнені насиченою парою. За звичайної температури тиск насиченої пари бульбашок набагато менший від зовнішнього тиску, тому ці бульбашки сплюснуті і мають мікроскопічні розміри. З підвищенням температури тиск насиченої пари в бульбашці зростає. За деякої граничної температури для кожної рідини, яку називають температурою кипіння, тиск пари всередині бульбашок переважає зовнішній, внаслідок чого бульбашки збільшуються в об’ємі і під дією сили Архімеда спливають на поверхню та лопаються (рис. 2). На місці цих бульбашок утворюються інші, і вся рідина закипає. Чим більший зовнішній тиск, тим вищою буде температура кипіння і навпаки. Кожна рідина має свою температуру кипіння, яка залежить від тиску насиченої пари. Чим більший тиск насиченої пари, тим менша температура кипіння. Чим менший тиск насиченої пари, тим більша температура кипіння. Рис. 2
З поверхні водойм, вологого ґрунту, листків рослин, легенів і шкіри тварин та людини в атмосферу Землі випаровується величезна кількість водяної пари (1014 т/рік), тому атмосферне повітря завжди вологе. Вміст водяної пари в повітрі, тобто його вологість, можна охарактеризувати декількома величинами.
Атмосферне повітря є сумішшю різних газів (N2 = 78%, O2 = 21%, інертні гази, водяна пара). Тиск, який чинила б водяна пара, коли б не було інших газів, називають парціальним тиском водяної пари. Парціальний тиск пари ще називають пружністю. За парціальним тиском водяної пари не можна судити про те, наскільки водяна пара в цих умовах близька до насиченої. Тому ввели величину, яка показує наскільки водяна пара за певної температури близька до насичення – відносну вологість повітря.
Відносна вологість – це відношення парціального тиску водяної пари p, що міститься в повітрі за певної температури, до тиску pн насиченої пари (за такої самої температури), виражена у відсотках: 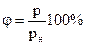 .
.
Абсолютна вологість – це кількість водяної пари в повітрі, виражена для зручності в грамах на кубічний метр (г/м3), або це густина ненасиченої пари.
Вологість повітря вимірюють спеціальними приладами – психрометром, гігрометром та ін. Психрометр складається з двох термометрів: резервуар одного з них, який показує температуру повітря, залишається сухим, резервуар другого оточений шматком тканини, опущеної у воду. Вода випаровується і завдяки цьому термометр охолоджується. Чим більша відносна вологість j, тим менш інтенсивне випаровування і тим вищу температуру показує термометр, оточений вологою тканиною. За різницею температур термометрів і спеціальною таблицею можна визначити j повітря.
Для людини сприятливим є значення φ = 40-60%. Якщо знижується температура ненасиченої пари, то її відносна вологість буде зростати без додаткового випаровування води.
3. Будь-яка хімічна однорідна речовина може бути за одних умов у газоподібному стані, а за інших – у рідкому. Водночас за своїми властивостями гази і рідини суттєво відрізняються. Рідини, як і гази, не мають певної форми і набувають форми тієї посудини, в якій знаходяться, але газ не має власного об’єму V i займає будь-який наданий йому об’єм. Об’єм же рідини – сталий. Газ відносно легко стискається, а рідини майже нестисливі. Можливість вільного переміщення молекул рідини одна відносно одної обумовлює їх цінність.
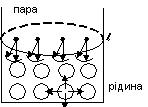 Найбільш характерною властивістю рідини, що відрізняє її від газу, є те, що на межі з газом рідина утворює вільну поверхню (рис. 3). На кожну молекулу рідини діють сили притягання сусідніх молекул.
Найбільш характерною властивістю рідини, що відрізняє її від газу, є те, що на межі з газом рідина утворює вільну поверхню (рис. 3). На кожну молекулу рідини діють сили притягання сусідніх молекул.
Ці сили для молекул, що знаходяться всередині рідини, взаємно скомпенсовані. Рівнодійна ж сил притягання, що діє на молекули, які знаходяться на поверхні розділу, напрямлена вниз (всередину рідини).
Рис. 3
На поверхні утворюється дефіцит молекул, через що відстань між молекулами набагато більша від норми, тому поверхневий шар рідини розтягнутий і між молекулами на поверхні діють сили притягання або сили поверхневого натягу.
Коефіцієнт поверхневого натягу дорівнює відношенню сили поверхневого натягу Fпов до довжини лінії l, що обмежує поверхню розділу: 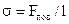 .
.
У СІ [σ] = Н/м.
Цей коефіцієнт, визначений для всіх рідин і занесений до таблиць, не залежить від довжини контуру, а визначається фізичними властивостями рідини, її станом. Унаслідок підвищення температури коефіцієнт σ зменшується. На значення коефіцієнта також впливає наявність у рідині домішок. Речовини, невеликі кількості яких значно зменшують σ, називають поверхнево-активними речовинами. Поверхнево-активні речовини входять до складу всіх мийних засобів.
Для води поверхнево-активними речовинами є етиловий спирт, ефір, мило, різні пральні порошки. У процесі прання білизни значення а зменшується як через нагрівання рідини, так і внаслідок введення мийних засобів.
Коли поверхневий шар рідини межує з твердим тілом, то слід враховувати взаємодію молекул рідини і твердого тіла. У повсякденному житті можна спостерігати, що крапля води розпливається по чистій поверхні скла, але не розпливається по забрудненій жиром поверхні і мас при цьому форм) майже правильної кулі. У першому випадку говорять, що вода змочує поверхню (рис. 4.а), у другому – не змочує (рис. 4.б). Якщо взаємодія молекул рідини між собою менша, ніж їх взаємодія з молекулами контактного твердого тіла, то маємо випадок змочування і навпаки, коли ця взаємодія більша – незмочування.
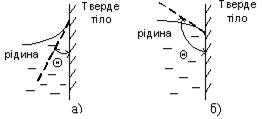
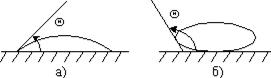
Рис. 4 Рис. 5
Інтенсивність змочування характеризується кутом змочування 0, який утворюється між дотичною до поверхні рідини і поверхнею твердого тіла. Відлік кута виконують у бік рідини. Якщо 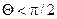 (рис. 5.а), поверхня тіла змочувана, а якщо
(рис. 5.а), поверхня тіла змочувана, а якщо 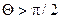 незмочувана (рис. 5.б).
незмочувана (рис. 5.б).
Поверхня рідини (меніск) у разі змочування мас увігнуту форму. Поверхня рідини внаслідок незмочування мас опуклу форму.
Явища змочування і незмочування відіграють важливе значення в побуті і техніці, якби вода не змочувала тіло людини, то марним було б купання. Добре змочування потрібне під час фарбування і прання, паяння, збагачення руд цінних порід та інших технічних процесів.
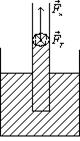 Явище змочування і незмочування виявляється у піднятті і спусканні рідини в тонких трубках (капілярах). Розглянемо капілярні явища.
Явище змочування і незмочування виявляється у піднятті і спусканні рідини в тонких трубках (капілярах). Розглянемо капілярні явища.
Опустимо в рідину густиною р капіляр радіусом r ≈ 1 мм.
Нехай рідина змочує стінки капіляра вздовж поверхні розділу „рідина – стінки – пара” (рис. 6). Сили поверхневого натягу будуть піднімати рідину в капілярі. У широких трубках таке явище не спостерігається.
Висота підняття рідини для циліндричного капіляра знаходиться за формулою:
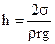 ,
,
Рис. 6
де h – висота підняття рідини в циліндричному капілярі; σ – коефіцієнт поверхневого натягу рідини; ρ – густина рідини; r – радіус капіляра; g – прискорення вільного падіння.
Якщо рідина не змочує капіляр, то в цьому разі рівень рідини в ньому буде нижчим від рівня рідини в посудині. Різниця цих рівнів, яку також позначають через має таку саму залежність від σ, ρ і r, як і у разі змочування.
Капілярні явища мають велике значення в природі і техніці. Завдяки цим явищам відбувається проникнення вологи з ґрунту в стебла і листя рослин. Саме в капілярах відбуваються основні процеси, пов’язані з диханням і живленням організмів. У тілі дорослої людини приблизно 160∙109 капілярів, загальна довжина яких сягає 60-80 тис. км.
У будівництві враховують можливість підняття вологи по капілярних порах будівельних матеріалів. Для захисту фундаменту і стіп від дії ґрунтових вод та вологи застосовують гідроізоляційні матеріали: толь, смоли тощо.
Завдяки капілярному підняттю вдається фарбувати тканини.
Часто капілярні явища використовують і в побуті. Застосування рушників, серветок, гігроскопічної вати, марлі, промокального паперу можливе завдяки наявності в них капілярів.
4. Твердиминазивають такі тіла, які зберігають об’єм і форму навіть під час дії на них інших тіл (сил). Причиною такої стійкості є характер руху і взаємодії молекул: вони не можуть змінювати положення своєї рівноваги, здійснюючи малі коливання і обертаючись навколо нього. Енергія і амплітуда коливань тим більша, чим вища температура тіла.
За впорядкованістю положення рівноваги тверді тіла поділяють на кристалиі аморфні тіла.
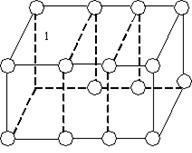 Кристали– це тверді тіла, в яких атоми або молекули розміщені впорядковано і утворюють періодично повторювану внутрішню структуру. Можна виділити маленький об’єм (елементарну комірку), завдяки якій можна побудувати весь кристал, як будинок із цегли (рис. 7). Елементарна комірка може мати форму куба, паралелепіпеда, призми тощо. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах (візерунки на вікнах під час морозу, правильні форми сніжинок, кристалів кухонної солі, гірського кришталю тощо). Кристали однієї тієї самої речовини можуть мати різну форму, яка залежить від умов їх утворення; вони можуть відрізнятися і кольором. Іноді весь шматок твердої речовини може становити один кристал. Такими є, наприклад, шматочки цукру в цукровому піску, шматочки солі, гірського кришталю тощо. Усе це окремі кристали, їх називають монокристалами.
Кристали– це тверді тіла, в яких атоми або молекули розміщені впорядковано і утворюють періодично повторювану внутрішню структуру. Можна виділити маленький об’єм (елементарну комірку), завдяки якій можна побудувати весь кристал, як будинок із цегли (рис. 7). Елементарна комірка може мати форму куба, паралелепіпеда, призми тощо. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах (візерунки на вікнах під час морозу, правильні форми сніжинок, кристалів кухонної солі, гірського кришталю тощо). Кристали однієї тієї самої речовини можуть мати різну форму, яка залежить від умов їх утворення; вони можуть відрізнятися і кольором. Іноді весь шматок твердої речовини може становити один кристал. Такими є, наприклад, шматочки цукру в цукровому піску, шматочки солі, гірського кришталю тощо. Усе це окремі кристали, їх називають монокристалами.
Рис. 7
Тіло, яке складається з безлічі невпорядковано розміщених кристалів, називають полікристалічнимиабо полікристалом(„морозні візерунки” на вікнах, цукор рафінад, метали тощо).
Умовно можна назвати чотири типи зв’язків між частинками в кристалах – іонний, атомний, металічний, молекулярний– і відповідно поділити тверді тіла на чотири типи кристалів.
У вузлах ґратки іонних кристалівмістяться додатно і від’ємно заряджені іони. До таких кристалів належать кристали кухонної солі, польового шпату, MgO тощо.
Класичним прикладом атомного кристалує кристал алмазу, який складається з нейтральних атомів вуглецю. Атомні кристали утворюються тоді, коли між атомами кристала виникають ковалентні зв’язки. Ковалентні сили забезпечують найміцніший зв’язок атомів у єдині кристалічні ґратки, тому атомні кристали характеризуються високими значеннями твердості, температури плавлення і теплоти випаровування.
У вузлах кристалічних ґраток молекулярних кристалівмістяться молекули речовини, зв’язок між якими забезпечується силами молекулярної взаємодії. Оскільки ці сили слабкіші від сил іонного і ковалентного зв’язків, молекулярні кристали є менш міцними, плавляться за дуже низької температури (тверді гелій, водень, кисень, „сухий лід”, нафталін, кристали брому, льоду, більшість кристалів органічних речовин).
Кристалічні ґратки металівутворюються додатними іонами металу, які містяться в її вузлах. Електрони і додатні іони металу взаємно зв’язуються. Електрони не можуть покинути метал через притягання до додатно заряджених іонів металу, а кристалічні ґратки, утворені з цих атомів, не розпадаються завдяки цементуючій дії електронів.
Всі кристали мають чітку температуру плавлення, різну для різних речовин.
Аморфні тіла– це тіла, що не мають чіткої температури плавлення. Прикладами аморфних тіл є шматки затверділої смоли, янтар, вироби із скла. За своєю будовою аморфні тіла нагадують дуже густі рідини (рис. 8). Унаслідок підвищення температури час осілого життя молекул зменшується, через що аморфне тіло поступово м’якне. Вони на відміну від кристалів з підвищенням температури неперервно перетворюються на рідину.
 Друга особливість аморфних тіл – це їх пластичність,тобто вони не мають межі пружності. Аморфний стан нестійкий: через деякий час аморфна речовина переходить в кристалічний стан. Але часто цей час буває дуже тривалим (роки і десятиріччя). До таких тіл належить скло. Будучи спочатку прозорим, протягом багатьох років воно мутнішає: у ньому утворюються дрібні кристалики силікатів.
Друга особливість аморфних тіл – це їх пластичність,тобто вони не мають межі пружності. Аморфний стан нестійкий: через деякий час аморфна речовина переходить в кристалічний стан. Але часто цей час буває дуже тривалим (роки і десятиріччя). До таких тіл належить скло. Будучи спочатку прозорим, протягом багатьох років воно мутнішає: у ньому утворюються дрібні кристалики силікатів.
У практичній діяльності людини великого значення набули аморфні речовини, які називають полімерами.Це високомолекулярні сполуки.
Відносна молекулярна маса полімерів може змінюватися від декількох тисяч до мільйонів.
Рис. 8
До них належать такі природні речовини, як бавовна, шерсть, дерево, шкіра, натуральний шовк, каучук, ебоніт тощо. Величезну кількість полімерних матеріалів видобувають штучно: віскозний шовк, синтетичний каучук, целофан, органічне скло, поліетилен, пластичні маси, штучні волокна, епоксидні смоли та ін. До природних полімерів належать і біополімери: білки, нуклеїнові кислоти. Із біополімерів побудовано клітини всіх живих організмів. Полімери – основа гуми, лаків, фарб, клеїв, іонітів тощо. Завдяки введенню до полімерів домішок, можна створювати речовини з дуже цінними якостями: високою твердістю, легкістю, вогнестійкістю та ін.
Крім аморфного, відкрито ще один стан речовини з подвійною природою – і рідини, і твердого тіла – це так звані рідкі кристали,особливий стан деяких органічних речовин. Для них характерна плинність і вони утворюють краплі. Молекули у краплі розміщуються порядком, не властивим звичайним рідинам і твердим тілам.
Зовнішня механічна або теплова дія на тверді тіла викликає зміщення атомів із рівноважних станів і приводить до зміни форми й об’єму тіла, тобто до його деформації.Спостерігаються деформації розтягу, стиску, зсуву і кручення. Найпростішими з них можна вважати деформації розтягу і стиску. Розтягу зазнають троси підіймальних кранів, буксирні троси, струни музикальних інструментів. Стиску зазнають стіни і фундаменти будівель.
Значна відмінність кристалічних тіл від аморфних виявляється в процесах плавлення і тверднення.Плавленнямназивають процес переходу речовини із твердого стану в рідкий. Зворотний процес переходу речовини із рідкого стану в твердий називають кристалізацією (твердненням). Досліди показують, що кристалічні тіла плавляться і тверднуть за певної для кожної речовини температури, яку називають температурою плавлення.Під час нагрівання кристалічного тіла інтенсивність коливального руху молекул в кристалі підвищується, а з досягненням температури плавлення коливання стають такими інтенсивними, що молекули (атоми) вже не можуть утриматися у вузлах ґратки і вони руйнуються – відбувається плавлення. Для кожного кристалічного тіла температура плавлення своя.
Аморфні тіла не мають певної температури плавлення або тверднення. У процесі плавлення (або тверднення) температура аморфних тіл неперервно змінюється.
Кількість теплоти, що потрібна для повного перетворення 1 кг кристалічної речовини із твердого стану в рідкий за сталої температури плавлення, характеризують питомою теплотою плавлення:

Із формули випливає, що для плавлення кристалічного тіла масою тйому потрібно надати кількість теплоти, пропорційну масі тіла: Q = λm.
У СІ питому теплоту плавлення виражають в джоулях на кілограм (Дж/кг). Питому теплоту плавлення кристалічної речовини визначають експериментально за допомогою калориметра.
Задачі
1. Як зміниться висота підйому рідини в капілярі, якщо його замінити грубкою, радіус якої в 2 рази менший?
А) збільшиться в 2 рази;
Б) зменшиться в 2 рази;
В) не зміниться;
Г) інша відповідь.
2. В якому капілярі вода підніметься па більшу висоту: 0,5 мм чи 0,1 мм?
3. В капілярній трубці, радіус якої 0,5 мм, рідина піднялася на висоту 11 мм. Визначити густину цієї рідини, якщо її коефіцієнт поверхневого натягу становить 22 мН/м.
4. Чому маленькі краплі роси на листках деяких рослин мають форму кульок, а листки інших рослин покриває шаром?
5. Використовуючи таблицю коефіцієнтів поверхневого натягу рідин, заповнити таблицю,
визначивши всі дані:
| № з/п | σ, мН/м | r, мм | ρ, кг/м | h, м |
| 0,5 | ||||
| 0,061 | ||||
| 0,15 | 0,076 |
Домашнє завдання
Вивчити матеріал конспекту.
Запитання для самоперевірки:
1) Що називають пароутворенням? Конденсацією? Випаровуванням? Парою?
2) Що називають кипінням?
3) Що розуміють під вологістю повітря?
4) Що називають абсолютною вологістю повітря? Яка формула виражає зміст цього поняття? У яких одиницях її виражають?
5) Що називають відносною вологістю повітря? У яких одиницях її виражають?
6) Що називають поверхневим натягом?
7) Наведіть приклади дії сил поверхневого натягу.
8) Виконавши пояснювальний рисунок, розкрийте фізичну сутність явищ змочування і незмочування.
9) Що називають капілярністю?
10) Чому фундамент цегляних будинків покривають гарячим бітумом чи обкладають толем?
11) Наведіть приклади врахування і використання капілярних систем у повсякденному житті.
12) Чим відрізняються кристалічні тіла від аморфних?
13) Назвіть основні властивості кристалічних тіл.
14) Які основні властивості аморфних тіл.
15) Що таке деформація?
16) Яку деформацію називають пружною? Пластичною?
17) Назвіть види деформацій.
18) Що таке плавлення, кристалізація?
Розв’язати задачі, що залишились.
Теми рефератів
1) Швидкість молекул газу. Температура
2) Перегріта рідина
3) Критичний стан речовини
4) Будова і принцип роботи волосяного і конденсаційного гігрометрів та психрометра
5) Експериментальне визначення поверхневого натягу рідин
6) Застосування поверхнево-активних речовин
7) Капілярні явища у природі
8) Вирощування кристалів
9) Рідкі кристали: фізична природа та використання
10) Процес горіння
| <== предыдущая лекция | | | следующая лекция ==> |
| Преобразование текста в надпись | | | ГОСУДАРСТВЕННЫЙ И МУНИЦИПАЛЬНЫЙ КРЕДИТ |
Дата добавления: 2015-10-26; просмотров: 2434;
