Термические методы анализа
Термические методы анализа основаны на измерении температур фазовых переходов и теплот химических реакций. Развитие получили следующие виды термического анализа:
- термометрия (термоанализ) - измерение температуры фазовых переходов
- - плавление, кипение, затвердевание веществ и их смесей;
- термогравиметрия - измерение массы веществ, подвергаемых нагреванию;
- калориметрия (энталышметрия) - измерение теплоты химических реакций;
- термометрическое титрование - титрование, в котором точка эквивалентности определяется по изменению температуры титруемой смеси.
По способу отсчета различают следующие виды термометрического анализа - прямые, в которых определяют значение температуры или количество теплоты, и дифференциальные, основанные на измерении разности температур.
Термометрические методы основаны на положениях и законах термодинамики. При протекании любой химической реакции изменяются свободная энергия системы Е°; ее изменения Е° связаны с константой равновесия К химической реакции, а также с изменениями энтальпии & Н°, энтропии 8° и температурой Т соотношениями:
E° = -RTlnK, (13.1)
Е° = ΔН°-ТΔS0. (13.2)
Изменения энтальпии регистрируют либо по тепловому эффекту реакции Q, либо по изменениям температуры системы л Т, поскольку обе эти величины зависят от энтальпии:
Q = -n ΔH, (13.3)
Q = cΔT (13.4)
Т = ΔН°n/с, (13.5)
где n - число молей продукта реакций,
с - теплоемкость системы.
В уравнения 13.3 и 13.5 входит концентрация продукта реакции (число молей), что позволяет применять термометрические методы для аналитических определений.
Термометрические методы универсальны, поскольку любая химическая реакция сопровождается изменениями энергии в системе, обладает высокой чувствительностью, позволяет надежно устанавливать присутствие примесей, определять чистоту веществ, проводить идентификацию веществ по температурным константам и их изменениям, исследовать процессы нагревания, сушки, плавления, кристаллизации.
Термометрия
При нагреве или охлаждении вещества его температура непрерывно меняется, но в момент фазового перехода в некотором интервале наступает постоянство температуры, связанное с поглощением или выделением теплоты при изменении фазового состояния. Постоянная температура, сопровождающая плавление, затвердевание или кипение вещества, остается стабильной до завершения фазового перехода и только после этого перехода начинает изменяться дальше. Температуры фазовых переходов являются константами веществ и используются для определения их идентичности (по плавлению смешанных проб), для проведения физико-химического анализа и определения молекулярных масс веществ по изменению температуры фазового перехода системы.
Константы фазовых переходов являются важнейшими физико-химическими и идентификационными характеристиками веществ. Обычно определяют следующие константы: температуру плавления, температуру затвердевания, температуру кипения. При измерениях используют шкалу Цельсия, в которой за нулевую точку принята температура плавления льда, а за 100°С - температура кипения воды. Системой СИ рекомендуется к использованию термодинамическая шкала в Кельвинах К, где за нулевую отметку принимают температуру абсолютного нуля - 0°К или - -273.16°С. Температура плавления льда в этой шкале соответствует - +273.16°К.
t,˚C
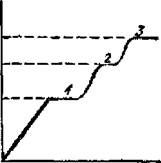
t,c
Рис. 18. Измерения температуры в момент фазового перехода: 1 - испарение кристализационной воды; 2- плавление примеси; 3- плавление вещества.
Термотитрометрия
Поскольку практически все химические реакции сопровождаются тепловым эффектом, за ходом реакции можно проследить, наблюдая за выделением или поглощением тепла при титровании в маленьком адиабатическом калориметре. Изменение температуры можно контролировать термопарой или термистором. При титровании между определяемым веществом и титрантом происходит химическая реакция, сопровождающаяся поглощением или выделением теплоты. В момент эквивалентности реакции температурные изменения в системе заканчиваются. Следовательно, поместив в титруемую смесь чувствительный датчик температуры, можно зафиксировать момент эквивалентности по прекращению изменений температуры смеси.
Кривые термометрического титрования регистрируют с помощью самописца в координатах «температура смеси» - «объем титранта» или «время титрования при постоянной скорости подачи титранта». В момент эквивалентности на кривой титрования наблюдается характерный перегиб, соответствующий прекращению изменений температуры смеси.
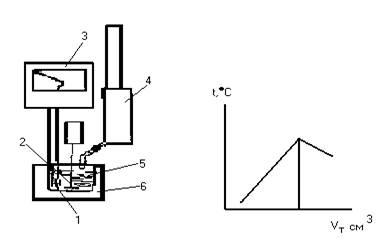
а) б)
Рис. 19. Схема установки для термометрического титрования (а) и вид кривой титрования (б): 1- термопара; 2- мешалка; 3- самописец; 4- блок автоматического титрирования; 5- титрируемый раствор; 6- термозащитный кожух
Недостатками метода являются его сравнительно невысокая точность, связанная с потерями теплоты в окружающую среду, и низкая избирательность.
Дата добавления: 2015-10-26; просмотров: 3052;
