Кинетика реакции разного порядка.
Рассмотрим более подробно реакции различного порядка. Так, существуют реакции нулевого порядка, когда скорость реакции не зависит от концентрации данного реагента.
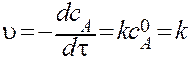
Следовательно, в течение всего процесса скорость остается постоянной, не зависящей от времени. (Разложение химических соединений на поверхности твердых тел).
В реакциях первого порядка (n=1) кинетическое уравнение принимает вид:
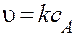 ;
;
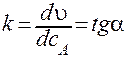 ,
, 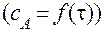
здесь скорость реакции пропорциональна концентрации вещества А.
Если же полученная зависимость в координатах υA – cA окажется нелинейной, то отсюда следует, что данная реакция не является реакцией первого порядка.
В этом случае, пользуясь приведенной методикой, можно предположить реакцию второго порядка ( 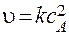 ) и построить график
) и построить график 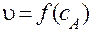 в координатах
в координатах  . Если он будет выражен прямой линией, значит это реакция 2-го порядка, если нет, следует предположить реакцию 3-го порядка и так далее.
. Если он будет выражен прямой линией, значит это реакция 2-го порядка, если нет, следует предположить реакцию 3-го порядка и так далее.
Таблица 1
Графическое определение порядка реакции.


Дата добавления: 2015-10-21; просмотров: 1091;
