Совокупность всех элементарных стадий, реализующая стехиометрическое превращение исходных веществ в продукты реакции, называется механизмом реакции.
Главная характеристика элементарной стадии (элементарной реакции) является ее молекулярность, то есть минимальное число частиц, необходимое для реализации данной стадии. Различают мономолекулярные, бимолекулярные и тримолекулярные элементарные стадии.
Тетрамолекулярные стадии, вследствие крайней малой вероятности одновременного столкновения четырех частиц, неизвестны.
Примеры элементарных стадий разной молекулярности:
Br2 → •Br + •Br (мономолекулярная);
H2 + •Cl →•H + HCl (бимомекулярная);
•H +•H + X → H2 + X* (тримолекулярная);
в последнем примере X – это частица, уносящая избыток энергии водородных атомов.
Понятие молекулярности реакции применимо только к одностадийным процессам. Однако большинство реакций протекает в несколько отдельных стадий (чаще всего моно- или бимолекулярных). В качестве примера рассмотрим реакцию взаимодействия диоксида азота и монооксида углерода в газовой фазе:
NO2 + CO = NO + CO2 (8.6)
Установлено, что реакция протекает в две стадии:
I. NO2 + NO2 = •NO3 + NO
II. •NO3 + CO = NO2 + CO2
Каждую из этих стадий можно назвать бимолекулярной элементарной реакцией.
На первой стадии происходит столкновение двух молекул NO2, в результате чего атом кислорода переходит от одной из молекул NO2 к другой.
На второй стадии образовавшийся интермедиат •NO3 передает атом кислорода молекуле CO, при этом образуются молекулы CO2 и NO2. Интермедиат не входит в число реагентов и продуктов реакции, так как образуется в одной элементарной стадии и поглощается в другой.
Алгебраическое суммирование отдельных стадий I и II приводит к общему стехиометрическому уравнению реакции (8.6).
Для выяснения реакционного пути (механизма) процесса очень важно понятие порядка реакции.
Порядок реакции определяется суммой показателей степеней в кинетическом уравненииυ= 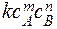 , то есть суммой m + n.
, то есть суммой m + n.
Различают общий (суммарный) порядок реакции и порядок по каждому из взаимодействующих веществ, когда определяют один из показателей степени
(m или n). Для установления порядка реакции необходимо установить самую медленную (лимитрующую) стадию, которая и будет определять общую скорость процесса.
В реакции (8.6) двум элементарным стадиям соответсвуют следующие кинетические уравнения:
медленная стадия: NO2 + NO2 = •NO3 + NO,
υ1= 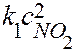 ;
;
быстрая стадия: •NO3 + CO = NO2 + CO2,
υ2= 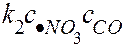
Следовательно, реакция является реакцией второго порядка по реагенту NO2. Интермедиаты типа •NO3 обычно образуются в низких, экспериментально не обнаруживаемых концентрациях и не входят в общее выражение скорости процесса.
Дата добавления: 2015-10-21; просмотров: 733;
