Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени.
Таким образом, выражение закона действующих масс для прямой реакции синтеза аммиака 3H2+N2→2NH3 можно записать
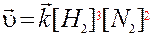 (8.2)
(8.2)
Сумму коэффициентов 2 + 3 называют порядком реакции.
Химическая реакция состоит из нескольких элементарных стадий.
I2 + H2 = 2 HI
Cтадия 1 : H2 + I = H2I (быстро)
Стадия 2 : H2I +I = 2 HI (медленно)
Суммарная: H2 +2 I = 2 HI
Наблюдаемая скорость реакции определяется скоростью самой медленной стадии.
Суммарное число частиц, участвующих в элементарной стадии называют молекулярностью.
Коэффициент пропорциональности 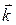 называется константой скорости химической реакции
называется константой скорости химической реакции
(в данном случае – это константа скорости прямой реакции).
Константа скорости имеет простой физический смысл. Она равна скорости данной реакции, когда концентрации всех реагирующих веществ равны единице (например, когда  моль/л). Константа скорости зависит от природы химической реакции (природы реагентов, продуктов взаимодействия, природы растворителя) и от температуры. От концентрации реагирующих веществ константа скорости не зависит.
моль/л). Константа скорости зависит от природы химической реакции (природы реагентов, продуктов взаимодействия, природы растворителя) и от температуры. От концентрации реагирующих веществ константа скорости не зависит.
Дата добавления: 2015-10-21; просмотров: 904;
