Локализация белковых полос осаждением ДДС-Na
Не очень чувствительные, но быстрые и простые методы по-
зволяют обнаружить полосы белка после электрофореза в при-
сутствии ДДС-Na по осаждению этого детергента. Наиболее
простой способ состоит в охлаждении геля до температуры 0—4°.
При боковом освещении на фоне черного бархата непрозрачные
белковые полосы и пятна хорошо видны среди почти прозрачно-
го геля. По-видимому, комплексы белок—ДДС-Na служат ядра-
ми конденсации большого количества мицелл ДДС-Na, раство-
римость которого очень сильно зависит от температуры. При
отргревании геля полосы и пятна исчезают. Нижний порог чув-
ствительности этого метода — 0,2 мкг белка на 1 мм2 площади
пятна [Wallace et al., 1974]. Попутно отметим недавно описан-
ный, аналогичный способ обнаружения белков в ПААГ, содержа-
щем 8 М мочевину. Гель выдерживают 5—10 мин при —70°.
В местах расположения белковых зон за счет связывания части
свободной воды белками мочевина кристаллизуется, давая не-
прозрачные полосы. Остальной гель при этом остается прозрач-
ным [Bachrach, 1981].
Недавно [Higgins, Dahmus, 1979] было предложено после
окончания электрофореза вымачивать гель в течение 1 ч при 25°
в 10—12 объемах 4 М раствора ацетата натрия. Свободный
ДДС-Na, который в концентрации 0,1% присутствует в геле, вы-
падает в осадок — гель становится белым и непрозрачным. Бел-
ки, связанные с ДДС-Na, при этом не осаждаются. Их прозрач-
ные полосы хорошо видны на темном фоне при освещении геля
сбоку и снизу. Чувствительность метода — 0,1 мкг белка на 1 мм2
площади пятна или полосы.
ЭЛЮЦИЯ БЕЛКОВ ИЗ ГЕЛЯ
Простейший прием элюции состоит в извлечении белка из по-
лоски или кусочка геля за счет диффузии в течение длительного
времени при 37—40°. Этот прием пригоден как для свободных
белков, так и для их комплексов с ДДС-Na. С целью облегчения
диффузии белков из геля последний измельчают, например рас-
тирают в маленьком стеклянном гомогенизаторе. Во время элю-
ции суспензию измельченного геля встряхивают. В элюирующий
буфер, как правило, вводят ДДС-Na даже в тех случаях, когда
электрофорез белка проводили без него. Это делают для облег-
чения растворения белков. После окончания экстракции гель
удаляют центрифугированием. От ДДС-Na и красителя белок
можно освободить осаждением и промывкой сначала смесью
ацетона с 0,1 М НС1 (6: 1), а затем чистым ацетоном. Осажден-
ный ацетоном белок высушивают или лиофилизируют. Брэй и
Браунли [Bray, Brownlee, 1973] элюировали таким образом бе-
лок в 0,05 М Na-фосфатный буфер <рН 7,5) с 0,1% ДДС-Na и
1 мМ ФМСФ ' при 37° в течение ночи при встряхивании. Белок
в комплексе с ДДС-Na осаждали (за счет ДДС-Na) добавле-
нием КС1 до 0,2 М и выдерживанием при 0°. Дрешер и Ли гомо-
генизировали кусочки геля в малом объеме 1%-ного раствора
ДДС-Na и элюировали белки в течение ночи при 40°. Такая кон-
центрация ДДС-Na оказалась необходимой для растворения
белков, осажденных в геле в ходе их фиксации кислотой и окра-
.шивания [Drescher, Lee, 1978]. В другой работе [Sreekrishna
et al., 1980] белки, предназначенные для последующего амино-
кислотного анализа, элюировали из ПААГ гомогенизацией в
0,05 М растворе бикарбоната аммония с 0,05% ДДС-Na и инку-
бацией в течение 10 ч при 37°. Бикарбонат аммония удаляли
повторной лиофилизацией. От ДДС-Na избавлялись, осаждая
белок добавлением 9 объемов подкисленного ацетона после рас-
творения лиофилизированного препарата в воде до концентра-
ции 1 % по ДДС-Na.
Иногда для улучшения растворения осажденного в геле бел-
ка экстракцию ведут в 1%-ном ДДС-Na с 6 М мочевиной [Buis-
son et al., 1976]. Щелочные негистоновые белки хроматина мож-
но экстрагировать 66%-ной уксусной кислотой на холоду [Rab-
bani et al., 1980]. Белки рибосом после двумерного электрофореза
и окраски СВВ R-250 можно также элюировать 66%-ной уксус-
ной кислотой. Краситель легко затем удалить на микроколонке
ДЭАЭ-целлюлозы прямо в той же кислоте. Анионный по своей
природе краситель десорбируется с белка и полностью задержи-
вается на анионообменнике, а щелочные рибосомальные белки
с ним не связываются [Bernabeu et al., 1980].
Описан способ экстракции белков в комплексе с ДДС-Na
60%-ной муравьиной кислотой [Gibson, Cracy, 1979], которую
——————
1 Фенилметилсульфонилфторид — ингибитор протеаз.
затем упаривают, а сухой остаток суспендируют в 6 н. НС1. Бе-
лок при этом растворяется, а ДДС-Na остается в осадке. Его
удаляют центрифугированием, а краситель из раствора белка в
кислоте извлекают троекратной экстракцией октанолом. Соля-
ную кислоту удаляют высушиванием в струе азота, разбавив
предварительно препарат водой.
Возможен и другой подход. Сначала ДДС-Na и краситель
экстрагируют из ПААГ без растворения осажденного в полосах
белка. Этого добиваются пятикратной гомогенизацией геля в
растворе, содержащем 10% ТХУ и 30% этанола. Гель каждый
раз осаждают центрифугированием. Из очищенного таким обра-
зом геля белки экстрагируют 0,1 М NaOH в течение 2 ч при 37°
при встряхивании [Djondjurov, Holtzer, 1979]. Для малых кон-
центраций белков в полосах этот метод не подходит, так как
часть белков вымывается при обработке геля ТХУ.
Нефиксированные белки удобно извлекать из геля возобнов-
лением электрофореза до выхода белка из геля. Содержащую
нужный белок полосу (или пятно) в геле локализуют сопостав-
лением с окрашенными белками в параллельном контрольном
треке на пластине, который предварительно отрезают, или в конт-
рольной трубке. Можно фиксировать положение полос и с по-
мощью данзилированных маркеров (см. выше). Вырезанный из
геля участок помещают в трубку на небольшую «пробку» из
крупнопористого ПААГ или агарозы и заливают буфером, а на
нижний конец трубки надевают заполненный буфером диализ-
ный мешочек. Затем возобновляют электрофорез и ведут его до
тех пор, пока белок не выйдет из трубки в мешочек [Weliky
et al., 1975]. Особенно удобно следить за выходом белка при на-
личии данзилированных маркеров. Если находящийся в диализ-
ном мешочке буфер содержит в избытке неионный детергент
(2% NP-40) и 8 М мочевину, то ДДС-Na практически полностью
вытесняется из связи с белком и уходит через мембрану к аноду
[Tuszynski et al., 1977].
Описан вариант, при котором белок электрофоретически
элюируют в трубку большего диаметра, где на пробке из ПААГ
лежит слой оксиапатита, уравновешенного 0,1 М Na-фосфатным
буфером (рН 7,2) с 0,1% ДДС-Na. Несмотря на действие элект-
рического поля, белок собируется на оксиапатите, откуда его
затем, разобрав всю систему, можно элюировать 0,5 М фосфат-
ным буфером [Ziola, Seraba, 1976].
Нитроцеллюлозные мембранные фильтры обладают способ-
ностью сорбировать щелочные белки. Этим можно воспользо-
ваться для получения «реплики». Фильтр накладывают на по-
верхность геля, и выходящие из него за счет диффузии белки
тут же сорбируются и располагаются на нитроцеллюлозе точно
такими же полосами, как и в геле. Далее уже на фильтре мож-
но проводить идентификацию белков, например гибридизацией
их с меченной 32Р ДНК [Bowen et al., 1980]. Простейшее устрой-
ство для этой цели, предложенное авторами цитируемой работы,
показано схематически на рис. 29. К пластине геля с двух сторон
металлическими сетками через пропитанные буфером поролоно-
вые прокладки прижимают нитроцеллюлозные фильтры (18x
x18 см) рабочей поверхностью к гелю. Фильтры предваритель-
но смачивают буфером, чтобы в них не оставалось окклюдиро-
ванного воздуха. Для этого следует дать им некоторое время по-
плавать на поверхности буфера, а потом уже погрузить в него.
Если электрофорез шел в присутствии ДДС-Na, белки пред-
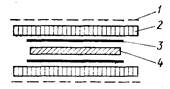
|
Рис. 29. Устройство для диф-
фузии белков из геля на нит-
роцеллюлозный фильтр [Bo-
wen et al., 1980]
/ — сетка из нержавеющей стади;
2 — поролон;3 — нитроцеллюлоз-
иый фильтр; 4—ПААГ
варительно освобождают от него, вымачивая гель в 0,01 М рас-
творе Трис-НСl (рН 7), содержащем 0,05 М NaCl, 2 мМ ЭДТА
и 4 М мочевину, в течение 3 ч с перемешиванием. Для более
полного освобождения от ДДС-Na в этот раствор можно сначала
ввести 1% Тритона Х-100, а потом отмывать тем же буфером без
детергента. Собранную, как описано выше, многослойную систе-
му погружают в 2 л того же буфера, но без мочевины. Диффузия
идет при комнатной температуре в течение 36—48 ч с одной сме-
ной буфера.
Белки на фильтре можно окрасить, а .радиоактивные—обна-
ружить флюорографией (см. ниже). Для этого высушенный
фильтр ненадолго замачивают в 10%-ном растворе ППО в эфи-
ре и накладывают на него рентгеновскую пленку. Флюорогра-
фия или авторадиография с фильтра идет значительно лучше,
чем с геля, так как белки сорбируются на поверхности мембран-
ного фильтра.
Выход белков из геля на фильтр можно значительно уско-
рить, использовав электрофоретическую элюцию белков из пла-
стины геля в поперечном направлении, подобно тому, как это
было описано для электрофоретической отмывки красителя
[Towbin et al., 1979]. Для этого собирают такую же систему, как
в предыдущем варианте, с тем лишь отличием, что нитроцеллю-
лозный фильтр («Millipore НА») накладывают на гель только с
одной стороны — той, куда будут мигрировать белки под дейст-
вием электрического поля. Весь «сэндвич» помещают в прибор
для электрофоретической отмывки геля и подбирают напряжение
так, чтобы напряженность поля в геле составляла около 6 В/см.
Если электрофорез белков вели в отсутствие ДДС-Na (напри-
мер, с мочевиной), то предварительное вымачивание геля и всех
компонентов системы, а также саму элюцию можно вести в
0,7%-ной уксусной кислоте. За 1 ч белки полностью выходятиз
геля в направлении катода и прочно сорбируются на нитроцел-
люлозе. Однако не следует допускать перегрузки фильтра: его
сорбционная емкость составляет примерно 0,15 мкг белка на
1 мм2 поверхности. Для проверки можно вслед за первым поло-
жить второй листок нитроцеллюлозы — на нем не должно быть
белка.
Если разделение белков вели в комплексе с ДДС-Na, то и
элюировать их можно в этом комплексе. В таком случае следует
использовать буфер того же типа, какой используют для верхне-
го электродного резервуара ступенчатой системы электрофореза
по Лэммли (0,192 М глицин, 25 мМ Трис, 20%-ный метанол; рН 8,3). Направление миграции белков—к аноду. Выход белка
при этом получается неполным.
Перешедшие на фильтр белки Таубин и соавторы идентифи-
цировали иммунологически. Подробное рассмотрение метода вы-
ходит за рамки этой книги, поэтому ниже он описан лишь вкрат-
це. Фильтр вымачивали в 3%-ном растворе бычьего сывороточ-
ного альбумина для насыщения оставшихся свободными центров
сорбции, затем инкубировали с антисывороткой к интересующе-
му белку, промывали и инкубировали с «индикаторными» анти-
телами к иммуноглобулинам первой сыворотки, конъюгирован-,
ными с флюоресцентным красителем или меченными радиоактив-
но. Перенос белков из геля на нитроцеллюлозный фильтр
существенно облегчает их иммунологическую идентификацию,
так как крупные молекулы g-глобулинов плохо диффундируют
в гель, тогда как фильтр сорбирует белки на своей поверхности
и они легко доступны для антител.
Описанный прием идентификации можно использовать во
всех случаях, когда белок способен образовывать специфические
комплексы (гормон—рецептор, рецептор—цАМФ, белок—нукле-
иновая кислота и др.), — конечно, при условии, что его активные
группы остаются открытыми при сорбции на нитроцеллюлозу.
Впрочем, последнее требование может относиться лишь к неболь-
шой доле молекул белка данного типа, достаточной для иденти-
фикации всей полосы.
Нитроцеллюлоза сорбирует только щелочные белки. Распро-
странение этого метода на любые белки связано с использова-
нием так называемой «диазобумаги», на которой предварительно
закреплены афинные сорбенты, например: антитела или антиге-
ны [Eriich et al., 1979]. Диазобумага была разработана и нашла
себе применение главным образом для гибридизации нуклеино-
вых кислот [Alwine et al., 1977], поэтому здесь нет места для
описания ее особенностей. Отметим только способ переноса бел-
ков из ПААГ на диазобумагу. После электрофореза белков в си-
стеме Лэммли ДДС-Na вымывают из геля 0,15 М Na-фосфатным
буфером (рН 7,4) с 0,15 М NaCl и 0,5% Тритона Х-100 при ком-
натной температуре в течение 1 ч. Затем гель кладут на стопку
фильтровальной бумаги в кювету, заполненную тем же буфером,
накрывают диазобумагой, а ее — несколькими слоями сухой
фильтровальной бумаги. Всю пачку прижимают через стеклян-
ную пластинку грузом. Буфер, поднимающийся из кюветы через
гель к сухой фильтровальной бумаге, за 1—2 ч при комнатной
температуре вымывает основную массу белка из геля. Нужный
белок задерживается на афинном сорбенте, остальные же уходят
дальше, в фильтровальную бумагу.
ОПРЕДЕЛЕНИЕ РАДИОАКТИВНОСТИ БЕЛКОВ
ПОСЛЕ ЭЛЕКТРОФОРЕЗА В ПААГ
Аппаратура, сцинтилляторы, различные методы счета радио-
активности белков, а также способы оценки эффективности этих
методов требуют отдельного подробного рассмотрения. Ниже в
очень сжатом виде будут описаны только некоторые приемы
оценки радиоактивности белков после их электрофореза в
ПААГ.
Дата добавления: 2015-10-21; просмотров: 1301;
