Произведение растворимости
В насыщенном растворе малорастворимого электролита непрерывно протекают два противоположно направленных процесса: растворение осадка и кристаллизация. В определенный момент времени устанавливается гетерогенное равновесие между твердой фазой и водным раствором, при этом скорость растворения осадка равна скорости кристаллизации. Так, для насыщенного раствора электролита 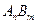 :
:
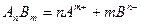 .
.
Поскольку этот процесс гетерогенный, то есть протекает на поверхности осадка, то константа равновесия этого процесса будет определяться только произведением концентраций ионов. В насыщенном растворе произведение молярных концентраций ионов малорастворимого электролита, взятых в степенях равных их стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимости ( 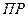 ):
):

где 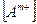 - концентрация катиона, моль/л;
- концентрация катиона, моль/л;
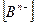 - концентрация аниона, моль/л;
- концентрация аниона, моль/л;
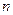 и
и  - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
Например, для малорастворимого электролита 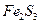 :
:

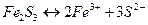
 .
.
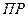 зависит от природы растворителя и растворенного вещества, от температуры и не зависит от концентрации ионов в растворе. Произведение растворимости и растворимость являются характеристиками малорастворимого вещества.
зависит от природы растворителя и растворенного вещества, от температуры и не зависит от концентрации ионов в растворе. Произведение растворимости и растворимость являются характеристиками малорастворимого вещества.
Растворимость - концентрация насыщенного раствора электролита, выражается в моль/л, г/л, г/100 г  . Молярная растворимость (
. Молярная растворимость ( 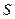 ) совпадает с молярной концентрацией насыщенного раствора и связана с
) совпадает с молярной концентрацией насыщенного раствора и связана с 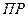 :
:

 =
= 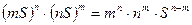 .
.
Для двухионных электролитов типа 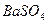 ,
, 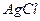 (m=1, n=1):
(m=1, n=1):

Для трехионных электролитов типа 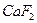 ,
, 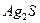 (m=1, n=2 или m=2, n=1):
(m=1, n=2 или m=2, n=1):
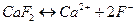
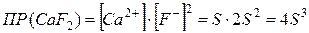 .
.
По известной растворимости вещества можно найти значение  и наоборот.
и наоборот.
Зная концентрации ионов малорастворимого электролита в растворе, можно рассчитать выпадет ли в данном случае осадок. Если при смешивании двух растворов, содержащих ионы малорастворимого электролита, оказывается, что произведение фактических концентраций ионов ( 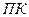 ) меньше
) меньше 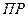 этого малорастворимого электролита, то осадок не образуется. Если
этого малорастворимого электролита, то осадок не образуется. Если 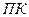 больше
больше 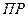 , то в таком растворе образуется осадок.
, то в таком растворе образуется осадок.
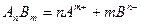

Таким образом:
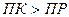 - условие образования осадка;
- условие образования осадка;
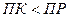 - условие растворения осадка.
- условие растворения осадка.
Вычисление произведения растворимости малораствoримого электролита
Пример 35. Растворимость оксалата серебра равна
3,27∙10-3 г/100 г  . Определите произведение растворимости
. Определите произведение растворимости 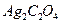 .
.
Решение: Молярная масса 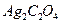 равна:
равна:
М( 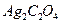 ) = 304 г/моль.
) = 304 г/моль.
Для перехода растворимости, выраженной в г/100 г  , к молярной концентрации, можно принять объем насыщенного раствора ≈ 100 мл, учитывая малую растворимость электролита в
, к молярной концентрации, можно принять объем насыщенного раствора ≈ 100 мл, учитывая малую растворимость электролита в  .
.
Молярная растворимость 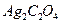 равна:
равна:
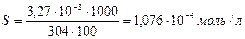 .
.
В насыщенном растворе оксалата серебра устанавливается гетерогенное равновесие:
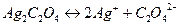 ,
,
из которого следует, что при диссоциации 1 моль 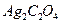 образуется 2 моль ионов
образуется 2 моль ионов 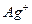 и 1 моль ионов
и 1 моль ионов 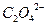 . Равновесные молярные концентрации ионов будут равны:
. Равновесные молярные концентрации ионов будут равны:
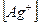 = 1,076∙10-4 ∙ 2 = 2,15∙10-4 моль/л;
= 1,076∙10-4 ∙ 2 = 2,15∙10-4 моль/л;
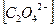 = 1,076∙10-4 моль/л;
= 1,076∙10-4 моль/л;
Тогда 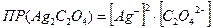 ;
;
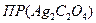 = (2,15∙10-4 )2 ∙ 1,076∙10-4 = 5 ∙10-12.
= (2,15∙10-4 )2 ∙ 1,076∙10-4 = 5 ∙10-12.
Вычисление растворимости и концентрации ионов
малорастворимого электролита в его насыщенном растворе
Пример 36. Произведение растворимости фосфата бария равно 6∙10-39. Вычислить растворимость (моль/л и г/л) и концентрации ионов в его насыщенном водном растворе.
Решение: Гетерогенное равновесие в насыщенном растворе 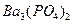 :
:
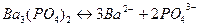
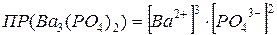 .
.
Обозначим концентрацию насыщенного раствора 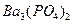 через
через 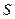 моль/л. Концентрация ионов в растворе пропорциональна молярной концентрации малорастворимого электролита и числу ионов, полученных при диссоциации молекулы. Тогда:
моль/л. Концентрация ионов в растворе пропорциональна молярной концентрации малорастворимого электролита и числу ионов, полученных при диссоциации молекулы. Тогда:
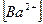 =3 S моль/л;
=3 S моль/л;
 = 2 S моль/л.
= 2 S моль/л.
Подставим эти величины в выражение 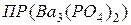 :
:
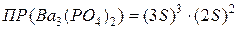 ;
;
6∙10-39 = 108 S5.
Решая уравнение относительно 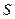 , получим:
, получим:
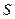 = 0,89∙10-8 моль/л
= 0,89∙10-8 моль/л
Концентрации ионов равны:
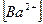 = 3 ∙ 0,89∙10-8 = 2,7∙10-8 моль/л;
= 3 ∙ 0,89∙10-8 = 2,7∙10-8 моль/л;
 = 2 ∙ 0,89∙10-8 = 1,8∙10-8 моль/л.
= 2 ∙ 0,89∙10-8 = 1,8∙10-8 моль/л.
Молярная растворимость 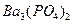 равна 0,89∙10-8 моль/л. Чтобы от молярной растворимости перейти к растворимости в г/л, необходимо молярную растворимость умножить на молярную массу вещества.
равна 0,89∙10-8 моль/л. Чтобы от молярной растворимости перейти к растворимости в г/л, необходимо молярную растворимость умножить на молярную массу вещества.
М( 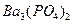 ) = З10 г/моль.
) = З10 г/моль.
Растворимость в г/л равна 310·0,89∙10-8 = 2,76∙10-6 г/л.
Ответ: 0,89∙10-8 моль/л; 2,76∙10-6 г/л.
Вычисление возможности образования осадка
Пример 37. Произведение растворимости сульфида марганца(II) равно 5,6∙10-16. Выпадет ли осадок при смешивании
4 мл 0,04 н. MnSО4 и 6 мл 0,01 М (NH4)2S?
Решение:Молекулярное уравнение реакции:
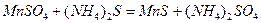 .
.
Ионно-молекулярное уравнение реакции:
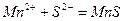 .
.
Для определения условия образования осадка необходимо рассчитать 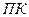 :
:
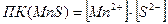 .
.
Для определения концентраций ионов 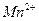 нужно перевести молярную концентрацию эквивалента
нужно перевести молярную концентрацию эквивалента 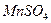 в молярную:
в молярную:
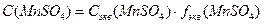 ,
,
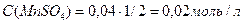 .
.
Определим концентрации ионов до сливания растворов:
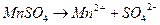
0,02 моль/л 0,02 моль/л
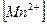 = 0,02 моль/л.
= 0,02 моль/л.
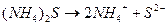
0,01моль/л 0,01моль/л
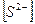 = 0,01 моль/л.
= 0,01 моль/л.
При смешивании растворов 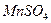 и
и 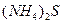 объем смеси стал 10 мл.
объем смеси стал 10 мл.
Концентрации ионов после смешивания растворов:
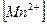 = (0,02 ∙ 4) / 10 = 0,008 моль/л.
= (0,02 ∙ 4) / 10 = 0,008 моль/л.
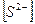 = (0,01 ∙ 6) /10 = 0,006 моль/л.
= (0,01 ∙ 6) /10 = 0,006 моль/л.
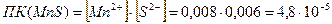
Сравниваем 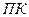 с
с 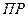 :
:
4,8 ∙ 10-5 > 5,6∙10-16 , т.е. 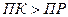 .
.
Следовательно, при сливании 4 мл 0,04 н. раствора 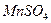 и 6 мл 0,01 М раствора
и 6 мл 0,01 М раствора 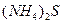 образуется осадок
образуется осадок 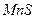 .
.
Исходные данные и результаты расчета заносим в таблицу:
| Ионы | Концентрация до сливания растворов, моль/л | Концентрация после сливания растворов, моль/л | 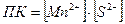
|

| 0,02 | (0,02∙4)/10 = 0,008 | 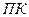 = 0,008 ∙ 0,006 =
4,8∙ 10-5 = 0,008 ∙ 0,006 =
4,8∙ 10-5
|
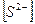
| 0,01 | (0,01∙6)/10 = 0,006 | 4,8 ∙ 10-5 > 5,6∙10-16 |
Дата добавления: 2015-10-19; просмотров: 4983;
