Задача 21
Составьте ионно-молекулярные и молекулярные уравнения гидролиза соли 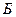 (...). Рассчитайте константу гидролиза, степень гидролиза и
(...). Рассчитайте константу гидролиза, степень гидролиза и 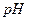 ... М раствора этой соли. Расчет произведите, учитывая только первую ступень гидролиза. Значения констант диссоциации кислот и оснований представлены в табл. 3 Приложения.
... М раствора этой соли. Расчет произведите, учитывая только первую ступень гидролиза. Значения констант диссоциации кислот и оснований представлены в табл. 3 Приложения.
| № варианта | Формула соли 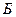
| Молярная концентрация раствора соли 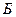
|
| C6H5COONa | 0,05 | |
| NH4CN | 0,1 | |
| KCN | 0,0004 | |
| Na2CO3 | 0,02 | |
| C6H5COOK | 0,03 | |
| NH4J | 0,01 | |
| Na3PO4 | 0,3 | |
| K2SO3 | 0,02 | |
| HCOOK | 0,1 | |
| CH3COONa | 0,001 | |
| CH3COONH4 | 0,01 | |
| K2SiO3 | 0,0001 | |
| NaCN | 0,04 | |
| NaHCO3 | 0,25 | |
| № варианта | Формула соли 
| Молярная концентрация раствора соли 
|
| LiNO3 | 0,01 | |
| AlCl3 | 0,0004 | |
| BeSO4 | 0,0025 | |
| Ni(NO3)2 | 0,36 | |
| Pb(NO3)2 | 0,0001 | |
| Zn(NO3)2 | 0,5 | |
| Na3AsO4 | 0,1 | |
| Na2MoO4 | 0,01 | |
| (NH4)2HPO4 | 0,15 | |
| (NH4)2SO4 | 0,25 | |
| Li2S | 0,005 |
Дата добавления: 2015-10-19; просмотров: 800;
