Сильные электролиты. Изотонический коэффициент
Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества в растворе увеличивается по сравнению с раствором неэлектролита той же концентрации. Поэтому коллигативные свойства проявляются в растворах электролитов в большей степени, чем в растворах неэлектролитов. Эта разница учитывается изотоническим коэффициентом i, который показывает, во сколько раз, экспериментально найденные величины  раствора электролита, превышают ту же величину, вычисленную для раствора неэлектролита такой же концентрации:
раствора электролита, превышают ту же величину, вычисленную для раствора неэлектролита такой же концентрации:
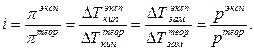
Величина 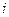 зависит от степени диссоциации
зависит от степени диссоциации 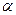 :
:
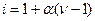 или
или 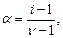
где 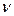 - число ионов, образующихся при диссоциации электролита.
- число ионов, образующихся при диссоциации электролита.
Например, для 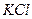
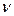 = 2; для
= 2; для 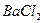
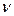 = 3 и т.д.
= 3 и т.д.
Пример 25. Раствор, содержащий 0,85 г 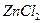 в 125 г воды, закипает при 100,06 °С. Определите кажущуюся степень диссоциации
в 125 г воды, закипает при 100,06 °С. Определите кажущуюся степень диссоциации 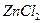 , температуру замерзания раствора, давление пара растворителя над раствором при температуре 34 °С, если давление водяного пара при данной температуре равно 5,318 кПа.
, температуру замерзания раствора, давление пара растворителя над раствором при температуре 34 °С, если давление водяного пара при данной температуре равно 5,318 кПа.
Решение: Экспериментально найденное значение повышения температуры кипения раствора составляет:
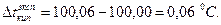
Найдем теоретическое повышение температуры кипения раствора:
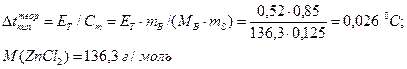
Вычислим изотонический коэффициент:
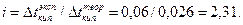
Определим кажущуюся степень диссоциации:
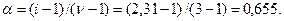
Найдем понижение температуры замерзания раствора:
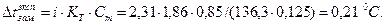
Температура замерзания раствора составит:
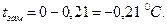
Определим понижение давления пара над раствором:
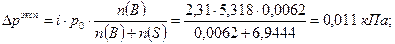
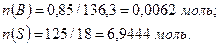
Давление пара над раствором составит:
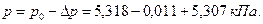
Дата добавления: 2015-10-19; просмотров: 1592;
