Сильные электролиты. Активность. Ионная сила
В растворах сильных электролитов в результате их практически полной диссоциации создается высокая концентрация ионов.
Между катионами и анионами возникает электростатическое притяжение и эффективная, (то есть экспериментально определенная) концентрация этих ионов оказывается меньше, чем их истинная концентрация.
Для оценки способности ионов к химическому взаимодействию в растворах сильных электролитов используют понятие - активности ( 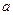 ).
).
Активностью иона называют эффективную или условную концентрацию его, соответственно которой он действует в химических реакциях.
Между активностью иона ( 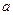 ) и его действительной концентрацией (
) и его действительной концентрацией ( 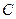 ) существует зависимость
) существует зависимость
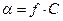 ,
,
где 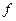 - коэффициент активности;
- коэффициент активности; 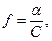 таким образом, коэффициент активности - это отношение активности иона к его общей концентрации. Так как
таким образом, коэффициент активности - это отношение активности иона к его общей концентрации. Так как 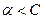 , то
, то 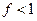 , поэтому при точных расчетах в уравнение закона действующих масс должны входить активности ионов, а не их концентрации. Если диссоциацию электролита изобразить схемой
, поэтому при точных расчетах в уравнение закона действующих масс должны входить активности ионов, а не их концентрации. Если диссоциацию электролита изобразить схемой
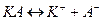 ,-
,-
то константа диссоциации 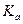 будет выражаться следующим образом:
будет выражаться следующим образом:
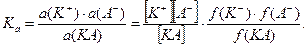
В этом случае 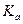 называют термодинамической константой.
называют термодинамической константой.
Понятие активности применимо не только к отдельным ионам, но и к электролиту в целом. Для электролита 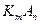 средняя активность и средний коэффициент активности связаны с активностями и коэффициентами активности катионов
средняя активность и средний коэффициент активности связаны с активностями и коэффициентами активности катионов 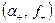 и анионов
и анионов 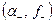 следующими соотношениями:
следующими соотношениями:
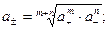
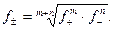
Коэффициенты активности ионов зависят не только от концентрации сильного электролита, но и от концентрации всех других ионов, присутствующих в растворе. Мерой электростатического взаимодействия между ионами является ионная сила раствора- 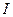 , которая вычисляется по формуле:
, которая вычисляется по формуле:
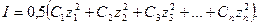
где 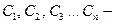 концентрации различных ионов, моль/л;
концентрации различных ионов, моль/л;
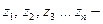 заряды этих ионов.
заряды этих ионов.
Пример 22.Определите ионную силу раствора, содержащего в 1 л одновременно 0,01 моль 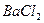 и 0,1 моль
и 0,1 моль 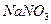 .
.
Решение: Ионная сила раствора будет определяться присутствием в нем ионов 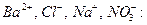
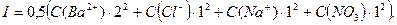
Считая, что 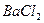 и
и 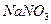 как сильные электролиты диссоциированы в растворе нацело, найдем концентрации ионов:
как сильные электролиты диссоциированы в растворе нацело, найдем концентрации ионов:
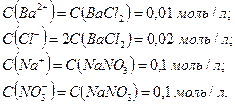
Теперь вычислим значение 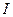 в растворе:
в растворе:
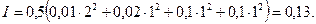
Средний коэффициент активности сильного электролита (или его ионов) и ионная сила раствора (для ионов одинакового заряда) связаны соотношением Дебая-Гюккеля:
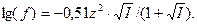
Для растворов с ионной силой 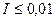 :
:
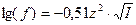 .
.
Пример 23. Рассчитать активность ионов и ионную силу раствора, содержащего в 1л 1,6 г 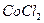 и 0,015 моль
и 0,015 моль 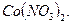
Решение: Ионная сила раствора выражается уравнением:
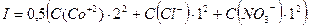
Определим концентрации ионов в растворе: 1,6 г 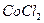 соответствует количеству вещества
соответствует количеству вещества 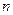 :
:
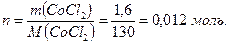
Общее число моль ионов 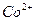 составляет
составляет 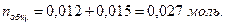 Следовательно:
Следовательно:
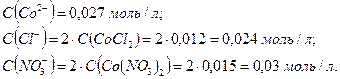
Рассчитаем ионную силу раствора:
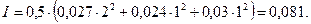
Рассчитаем значения коэффициентов активности ионов:
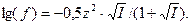
Для однозарядных ионов 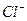 и
и 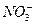 :
:
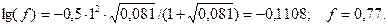
Для двухзарядного иона 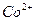 :
:
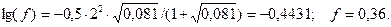
Вычисляем активности ионов:
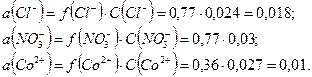
Пример 24. Рассчитайте ионную силу раствора и активность 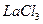 0,018 М растворе.
0,018 М растворе.
Решение: Ионная сила раствора:

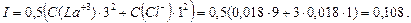
Определим по таблице приложения коэффициенты активности ионов 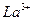 и
и 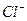 :
: 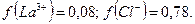 Рассчитаем активность ионов:
Рассчитаем активность ионов:
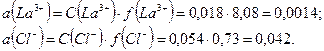
Найдем активность 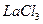 :
:
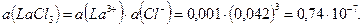
Дата добавления: 2015-10-19; просмотров: 13093;
