Электрический ток в растворах и расплавах электролитов. Закон электролиза
Растворы некоторых химических соединений в воде либо в других растворителях, а также расплавы, проводящие электрический ток, получили название электролитов. К электролитам можно отнести растворы многих солей, кислот, щелочей, а также расплавы солей и окислов металлов.
Проводимость электролитов является ионной. Это связано с диссоциацией молекул в среде с высокой диэлектрической проницаемостью на составляющие их положительные и отрицательные ионы.
Например: 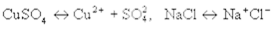 и т. д. (7.28)
и т. д. (7.28)
Процесс выделения составных частей химических соединений на электродах при прохождении электрического тока через электролит называется электролизом (рис. 7.9).
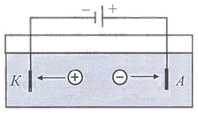
Рис. 7.9
Катионы (положительные ионы) и анионы (отрицательные ионы) на поверхности соответственно катода К и анода А нейтрализуются.
Регламентирует электролиз закон Фарадея, который определяет массу вещества, выделяемую на электродах при электролизе: масса вещества m, выделившегося на электроде при электролизе, прямо пропорциональна заряду q, прошедшему через электролит, то есть
m = kq = kIt, (7.29)
где k ¾ электрохимический эквивалент вещества.
Дата добавления: 2015-10-19; просмотров: 1557;
