Глава III. Строение вещества
| § 9. Химическая связь |
| Взаимодействие между атомами, молекулами, ионами, благодаря которому частицы удерживаются вместе, называютхимической связью. |
Атомы большинства химических элементов не могут долго существовать поодиночке. Они соединяются с такими же или другими атомами. Например, огромное количество атомов металлического элемента, соединяясь вместе, образует металл. Алмаз, графит, красный фосфор состоят из соединенных между собой атомов неметаллических элементов. Два атома кислорода объединяются в молекулу О2; из таких молекул состоит газ кислород. Вода содержит молекулы Н2О, каждая из которых образована двумя атомами водорода и одним атомом кислорода. Поваренная соль (хлорид натрия) состоит не из молекул, а из ионов Na+ и Cl –.
Образование химической связи всегда сопровождается выделением энергии, называемой энергией химической связи. Таким образом, причиной образования химической связи является уменьшение энергии, повышение устойчивости системы.
Среди простых веществ лишь инертные газы – гелий, неон, аргон, криптон, ксенон и радон (элементы VIIA группы) – состоят из отдельных атомов. Долгое время ученым не удавалось осуществить химические реакции с участием инертных газов. Причина химической пассивности этих веществ стала понятна только после открытия строения атома.
У неона, аргона, криптона, ксенона и радона на последнем энергетическом уровне по 8 электронов (среди них – два s-электрона и шесть p-электронов), исключением является гелий у которого два электрона заполняют первый энергетический уровень до завершения.
Учитывая химическую пассивность инертных газов и строение атомов соответствующих элементов, можно сделать вывод, что внешняя восьмиэлектронная оболочка является для атома выгодной и устойчивой. Ее часто называют электронным октетом.
Атомы остальных химических элементов стремятся приобрести электронный октет, образуя химические связи с атомами этого же или другого химического элемента, отдавая и принимая электроны либо обобществляя электроны.
| Выводы: |
1. Причиной образования химической связи является стремление атомов к достижению более устойчивого состояния, что приводит к выделению энергии при образовании химической связи.
2. Природа химической связи – электростатическая, т.е. определяется различными видами взаимодействий электронов и ядер в системе связанных атомов.
| § 10. Ионная химическая связь. |
Особенности строения атомов, образующих ионную химическую связь.Ионная химическая связь образуется между атомами типичных металлических элементов и типичных неметаллических элементов.
Особенностями атомов металлов является небольшое (1-3) количество электронов на последнем энергетическом уровне, у атомов же неметаллических элементов электронов на последнем энергетическом уровне от 4 до 8. Кроме того радиус атома металла больше радиуса атома неметалла, если они находятся водном периоде и имеют одинаковое количество энергетических уровней. Электроотрицательность металлов значительно меньше электроотрицательности неметаллов (∆ ОЭО > 2).
Рис. Радиусы атомов элементов III периода.

Образование ионной химической связи.Примером образования ионной связи является хлорид натрия (поваренная соль). Составляющие ее элементы – натрий и хлор находятся в III периоде периодической системы. Их относительная электроотрицательность (ОЭО) соответственно равна у Na – 1,1, а у Cl – 2,8. Натрий (№11) находится в периодической системе после инертного элемента неона. Электронная конфигурация атома натрия –
1s2 2s2 2p6 3s1. На последнем энергетическом уровне в атоме имеется лишь один электрон, а на предпоследнем – октет электронов (2s2 2p6 ). Электронная конфигурация атома хлора (№17) – 1s22s22p63s23p5, на последнем энергетическом уровне хлора семь электронов, среди них один неспаренный p-электрон. За счет неспаренных электронов между атомами натрия и хлора может образоваться химическая связь. Из-за большой разницы в электроотрицательности связь между атомами натрия и хлора будет образовываться за счет отдачи и присоединения электрона:
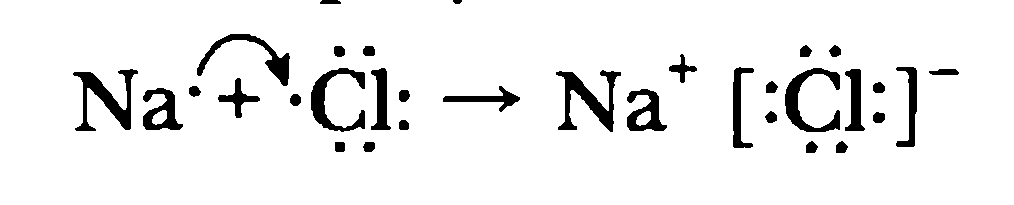
Ядра атомов при этом не изменяются (а значит, и сами элементы тоже). В ядре атома натрия содержится 11 электронов (заряд ядра равен +11), а электронов становится на один меньше, т. е. 10 (их суммарный заряд равен –10). Электронейтральный атом превращается в частицу, которая имеет заряд +11 – 10 = +1. Это – ион натрия Na+. Его электронное строение такое же, как и атома инертного элемента неона; ион натрия является устойчивой частицей с внешним октетом электронов (8 электронами на последнем энергетическом уровне).
Схема превращения атома натрия в ион натрия и электронные конфигурации этих частиц:
Na0 – 1e— → Na+;
атом Na0 – 1s2 2s2 2p6 3s1, или [Ne] 3s1;
ион Na+ – 1s2 2s2 2p6, или [Ne]
| Положительно заряженные ионы называются катионами. В каждом катионе содержится больше протонов, чем электронов. |
Катионы Na+ входят в состав почти всех соединений натрия, среди которых – оксид Na2O, гидроксид NaOH, различные соли.
В ядре атома хлора содержится 17 электронов (заряд ядра равен +17), а электронов становится на один больше, т. е. 18 (их суммарный заряд равен –18). Электронейтральный атом превращается в частицу, которая имеет заряд +17 – 18 = –1. Это – ион хлора Cl –. Его электронное строение такое же, как и атома инертного элемента аргона; ион хлора тоже является устойчивой частицей с внешним октетом электронов (8 электронами на последнем энергетическом уровне).
Схема превращения атома хлора в ион хлора и электронные конфигурации этих частиц:
Cl0 + 1e— → Cl –;
атом Cl0 – 1s2 2s2 2p6 3s2 3p5, или [Ne] 3s2 3p5;
ион Cl – – 1s2 2s2 2p63s2 3p6, или [Ar]
| Отрицательно заряженные ионы называются анионами. В каждом анионе содержится больше электронов, чем протонов. |
Анионы Cl– содержатся в солях соляной (хлороводородной) кислоты – хлориде натрия NaCl, хлориде кальция – CaCl2 и др.
| Химическая связь между ионами, осуществляемая за счет сил их электростатического притяжения, называется ионной связью. А соединения, которые образовались путем притяжения ионов, называются ионными. |
Как положительные, так и отрицательные ионы могут состоять не только из одного, но из нескольких элементов. Например, кристаллы калийной селитры (нитрата калия) KNO3 образованы положительными ионами (катионами) калия К+ и отрицательными нитрат – ионами (анионами) 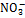 . Связь между ионами К+ и
. Связь между ионами К+ и 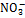 ионная, а между атомами N и О в ионе
ионная, а между атомами N и О в ионе 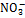 – ковалентная.
– ковалентная.
К ионным соединениям относятся оксиды металлов, щелочи, соли. Все эти вещества содержат ионы металлических элементов (например, Na+, Ca2+, Al3+). Анионами в ионных оксидах являются ионы О2–, в щелочах – ОН–, а в солях – ионы кислотных остатков (Cl–, 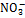 ,
, 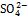 ,
, 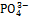 и др.).
и др.).
Кроме тог из ионов состоят некоторые другие бинарные соединения, образованные бинарными соединениями, образованные типичными металлическими элементами, например Li3N, Mg3P2, NaH.
Отличия ионов от атомов.Катион и атом натрия имеют одинаковые заряды ядер (+11), анион и атом хлора – тоже (+17). Однако состав электронных оболочек, размеры (радиусы), свойства простого иона и атома каждого элемента различны. Кроме того, ионы – заряженные ионы, а атомы – электронейтральные.
| АТОМЫ |
| Cl |
| Na |
| + 11) ) ) 2 8 1 |
| + 17) ) ) 2 8 7 |
1s2 2s2 2p6 3s1 или [Ne] 3s1 1s2 2s2 2p6 3s2 3p5 или [Ne] 3s2 3p5
R(Na) > R(Cl)
0,171 нм 0,072 нм
| ИОНЫ |
| Cl— |
| Na+ |
| + 11) ) 2 8 |
| + 17) ) ) 2 8 8 |
1s2 2s2 2p6 или [Ne] 1s2 2s2 2p6 3s2 3p6 или [Аr]
R(Na+) < R(Na) R(Na+) < R(Cl—) R(Cl—) ≈ R(Cl)
0,028 нм 0,171 нм 0,028 нм 0,074 нм 0,074 нм 0,072 нм
Сопоставив радиусы атомов и ионов, катионов и анионов, можно обнаружить такие закономерности:
• радиусы катионов меньше, чем радиусы соответствующих атомов;
• радиусы анионов и соответствующих атомов почти одинаковы;
• радиусы большинства анионов превышают радиусы катионов.
Сравним некоторые свойства катиона и атома водорода. Ионы Н+ содержатся в водном растворе кислоты и придают ему кислый вкус. Атомы водорода такими свойствами не обладают. В отличии от ионов, они легко соединяются друг с другом в молекулы Н2, из которых состоит простое вещество – водород.
Ионы в природе.При обычных условиях большинство ионных соединений находится в твердом агрегатном состоянии. При определенных условиях (высокие температуры, растворение в воде) ионные соединения распадаются на ионы. Ионы в природе существуют вокруг нас. Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья. Ионы активны, результатом их взаимодействия часто бывают негативные явления: насыщение почвы нитрат-ионом ( 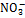 ), разрушение мраморных изделий сульфат-ионом (
), разрушение мраморных изделий сульфат-ионом ( 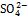 ), кислотные дожди (ионы Н+,
), кислотные дожди (ионы Н+, 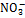 ,
, 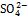 ), загрязнение воды и почвы токсичными ионами тяжелых металлов.
), загрязнение воды и почвы токсичными ионами тяжелых металлов.
Алгоритм составления схемы образования химической связи:
1. Записать формулу вещества.
| KF– фторид калия. |
2. Определить по номеру периода номер последнего энергетического уровня, по номеру группы количество валентных электронов. По количеству валентных электронов определить характер свойств элемента. Определить тип связи (по разнице в ОЭО)
К– 1 валентный электрон 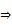 Ме, F – 7валентных электронов Ме, F – 7валентных электронов  неМе
ОЭО (К) = 0,91, ОЭО(Сl) = 4,1 ∆ ОЭО = 4,1 – 0,91 = 3,19 неМе
ОЭО (К) = 0,91, ОЭО(Сl) = 4,1 ∆ ОЭО = 4,1 – 0,91 = 3,19 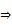 х. св. ионная х. св. ионная
|
3.
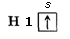 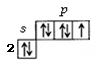
|
| F |
| к |
4. Валентные электроны каждого атома обозначают вокруг символа элемента. Составить схему образования связи для этого показать взаимодействие атомов (переход электронов от атома металла к атому неметалла для ионной связи).
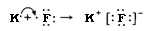
| Выводы: |
1. Наиболее устойчивая внешняя электронная оболочка атома или простого иона содержит восемь электронов.
2. Атомы металлических элементов способны отдавать электроны внешней оболочки и превращаться в катионы, а атомы неметаллических элементов – присоединять электроны и превращаться анионы.
3. Катионы и анионы притягиваются друг к другу за счет электростатических сил, между ними образуется ионная химическая связь.
4. Катионы имеют меньшие радиусы, чем соответствующие атомы. Радиусы анионов почти не отличаются от радиусов соответствующих атомов.
| § 11. Ионная кристаллическая решетка. |
Все ионные соединения в обычных условиях являются, как правило, кристаллическими веществами. Кристалл – это естественное твердое тело, которое имеет плоские грани
(поверхности) и прямые ребра (стыки поверхностей). Такая форма твердого тела является
результатом четкой последовательности в размещении частиц.
| Кристалламиназываются твердые тела с закономерным расположением в них частиц – атомов, молекул или ионов. |
Кристаллы каждого вещества имеют характерную форму. Если посмотреть на поваренную соль через увеличительное стекло, то увидим множество бесцветных прозрачных кубиков.
Форму кристалла изучает наука кристаллография. Химию интересует внутреннее строение кристаллов и зависимость свойств веществ от их кристаллической структуры.
В кристалле ионного вещества каждый катион находится в контакте с определенным количеством анионов, а анион – с таким же или другим количеством катионов. В любом направлении наблюдается строгое чередование катионов и анионов.
Последовательность размещения ионов внутри кристалла зависит от состава вещества, т. е. соотношения катионов и анионов, а также от соотношения радиусов этих частиц.
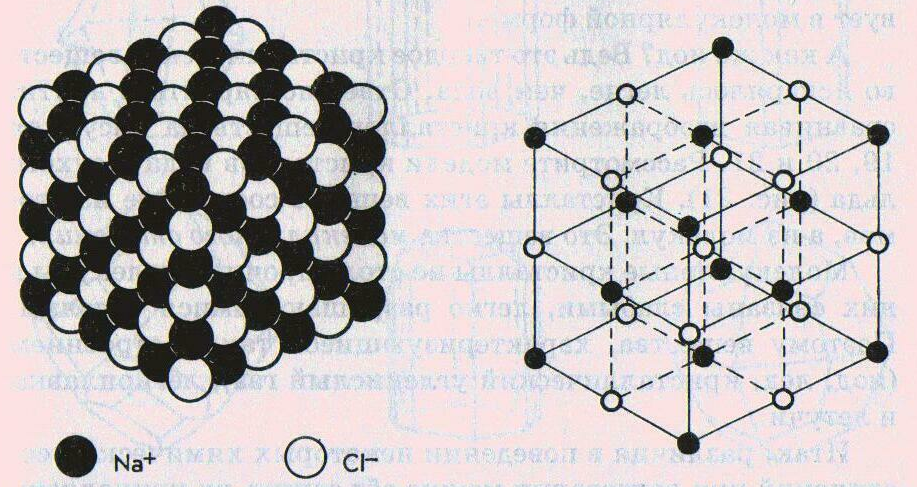
| Рис. Модель кристаллической решетки поваренной соли |
Шарики в кристаллической решетке имитируют частицы вещества – ионы, атомы, молекулы. Они размещены в так называемых узлах кристаллической решетки.
Ионные кристаллические решетки – это решетки, в узлах которых расположены ионы с противоположными зарядами. Связь между ионами осуществляется за счет электростатических сил притяжения (ионная химическая связь).
Физические свойства ионных соединений.Ионы соединяются друг с другом достаточно прочно. Поэтому все ионные вещества при обычных условиях находятся в твердом агрегатном состоянии.
Для того, чтобы разрушить ионную связь, необходимо затратить немалую энергию. Этим объясняют высокие температуры плавления и кипения большинства ионных веществ. При плавлении кристаллы разрушаются, связи между ионами ослабевают, а при кипении ионы отделяются друг от друга и «вылетают» из жидкости. Хлорид натрия плавится при температуре 8010С (ее нельзя достичь, нагревая вещество с помощью спиртовки), а кипит при температуре 14400С. Температуры кипения и плавления другого ионного соединения – оксида магния MgO – еще выше: 2825 и 36000С. Объяснить это можно так. Ионы Mg2+ и О2– имеют большие заряды и меньшие радиусы, чем ионы Na+ и Cl – соответственно, и поэтому прочнее соединяются.
Ионные вещества в твердом состоянии не проводят электрический ток, а в растворе и расплаве являются электропроводными.
| Электрический ток – это направленное движение заряженных частиц. |
В кристалле ионы занимают фиксированное положение и перемещаться не могут.
| Рис. Электропроводность расплавов и растворов ионных веществ |
Вещества с иной кристаллической решеткой не пластичны. Это можно объяснить тем, что при деформации кристаллической решетки слои смещаются друг относительно друга и ионная химическая связь разрушается (в какой-то момент катион оказывается напротив катиона, а анион напротив аниона и возникают силы отталкивания).
| |
| Рис. Деформация ионной кристаллической решетки |
| Деформация ионной кристаллической решетки |
| Выводы: |
1. Твердые вещества бывают кристаллическими и аморфными. В кристаллах частицы строго упорядочены и образуют кристаллическую решетку, в аморфных веществах они расположены хаотично.
2. Физические свойства веществ зависят от строения вещества (особенности строения атомы определяют тип химической связи, тип химической связи определяет тип кристаллической решетки, от типа кристаллической решетки зависят физические свойства).
| § 12. Ковалентная химическая связь. |
Соединяться могут не только противоположно заряженные ионы, но и нейтральные атомы – одинаковые или разные. Благодаря этому существуют вещества молекулярного и атомного строения.
Особенности строения атомов, образующих ковалентную химическую связь.Ковалентная химическая связь образуется между атомами неметаллических элементов.
У атомов элементов-неметаллов на последнем энергетическом уровне от 4 до 8 электронов. Радиус атома металла больше, чем радиус атома неметалла, если элементы находятся в одном периоде и их атомы имеют одинаковое количество энергетических уровней. Поэтому валентные электроны неметаллов гораздо сильнее притягиваются к ядру, чем валентные электроны атомов металлов. Электроотрицательность атомов неметалла одного итого же элемента одинакова, а электроотрицательность атомов различных неметаллов отличается незначительно (∆ ОЭО < 2).
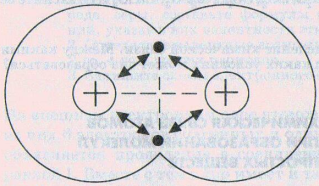
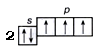
Образование ковалентной химической связи.Рассмотрим, как образуется молекула Н2 из двух атомов водорода. Каждый атом имеет один электрон. Электронная конфигурация
атома водорода – 1s1, его электронно-графическая схема
Для того, чтобы образовалась молекула Н2, двум атомам водорода необходимо сблизиться. Однако два атома водорода при их сближении и взаимодействии друг с другом могут образовать двухатомную молекулу не всегда. Химическая связь между двумя атомами водорода (или атомами других элементов) возможна в этом случае, если их электроны имеют противоположные спины (в противном случае преобладают силы отталкивания).
|
| + |
| + |
| + |
| Рис. Образование молекулы водорода. |
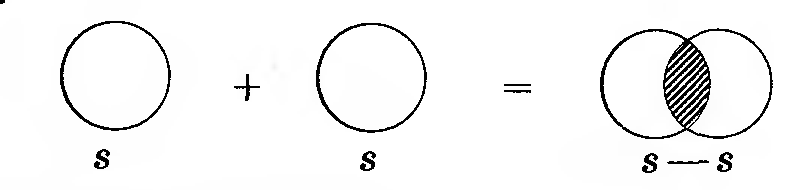
С уменьшением расстояние между атомами водорода усиливается притяжение электронов каждого атома к ядру другого атома. В определенный момент орбитали двух атомов соприкасаются, а затем начинают перекрываться. При этом будет возрастать отталкивание между одноименно (положительно) заряженными ядрами атомов. Когда силы притяжения и отталкивания уравниваются, атомы остановятся. В результате энергия системы, состоящей из двух атомов водорода, уменьшается (Е выделяется), между атомами образуется химическая связь. Область повышенной двухэлектронной плотности связывает два атома водорода в молекулу Н2.
| |
| Рис. Перекрывание электронных облаков при образовании молекулыводорода |
Условно уплотненную часть двухэлектронного облака называют общей электронной парой и обозначают ее 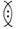 .
.
| Химическая связь между атомами, обусловленная образованием общих электронных пар, называют ковалентной связью. |
Схема образования ковалентной химической связи в молекуле водорода выглядит следующим образом:
| Атом Атом Молекула |
| Н2 – водород: |
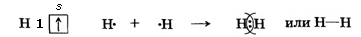
| Неспаренные Общая электроны электронная пара |
Схематично перекрывание электронных облаков изображают так:
Подобным образом осуществляется ковалентная химическая связь между атомами хлора, но она устанавливается уже между p-электронами атомов этого элемента:
 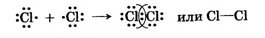
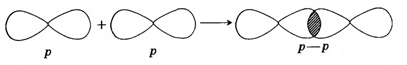
|
| Сl2 – хлор: |
| НСl – хлороводород |
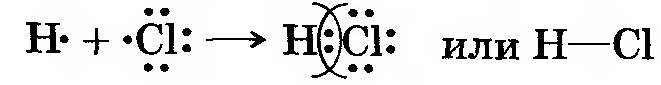
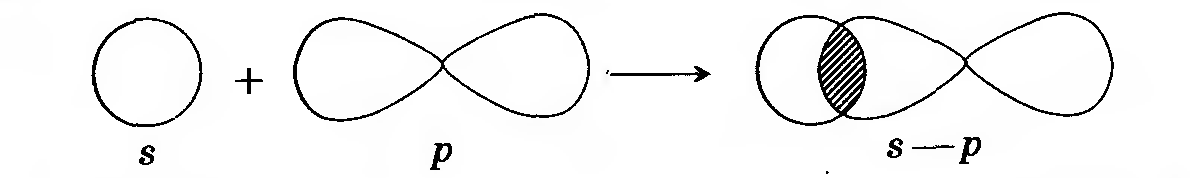
Связь возникает за счет образования общей электронной пары s- и p-электронов.
В молекулах водорода, хлора и хлороводорода атомы связаны одной общей электронной парой. Такую связь называют одинарной.
Химическая связь между атомами в молекулах может быть образована с помощью большего числа общих электронных пар. Это зависит от строения взаимодействующих атомов. С помощью общих электронных пар объединяются атомы и в двухатомной молекуле
 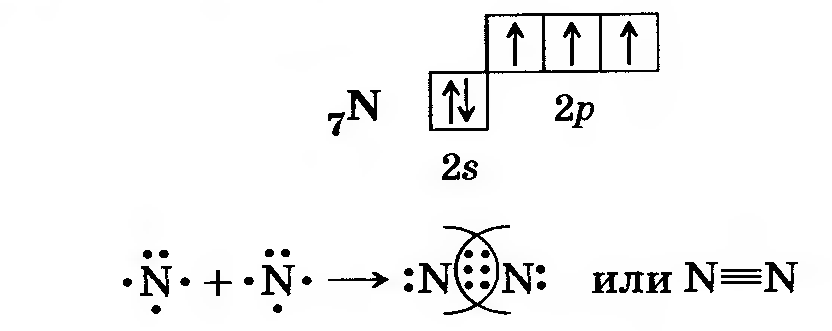
|
| N2 – азот: |
Из вышеизложенного следует, что необходимым условием для образования ковалентной связи между атомами является наличие у каждого из них одного или нескольких неспаренных электронов.
Увеличение числа электронных пар, связывающих атомы в молекулу, увеличивает энргию связи, а значит, прочность молекул:
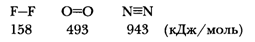
| в) |
| б) |
| а) |
|
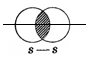
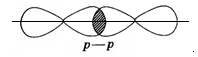
| Ковалентная связь, образованная перекрыванием орбиталей по линии, проходящей через ядра связанных атомов, называется σ-связью. |
2  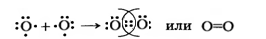
|
О2 – кислород:
В молекуле кислорода связь двойная. Одна общая электронная пара образуется за счет
σ–связи (электронная плотность находится на линии, проходящей через ядра связанных атомов.).

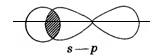
Другая связь образуется за счет перекрывания вертикально направленных p-орбиталей. Такое перекрывание происходит уже не по линии, проходящей через ядра связанных атомов, а по обе стороны от нее. Образуется не одна, а две области перекрывания. Такая ковалентная связь получила название π-связи
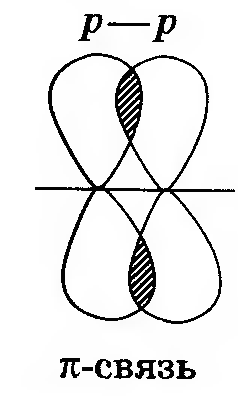
|
–
| Ковалентная связь, образованная перекрыванием орбиталей по обе стороны от линии, проходящей через ядра связанных атомов, называется π-связью. |
Если одинарная связь всегда является σ–связью (молекула водорода), то двойная связь состоит из одной σ–связи и одной π-связи (молекула кислорода), тройная же связь состоит из из одной σ–связи и двух π-связей (молекула азота)
. 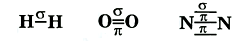
Область перекрывания орбиталей в случае σ–связи больше, чем в случае π-связи, поэтому энергии при образовании σ–связи выделяется больше, чем при образовании π-связи.
Поэтому σ–связь прочнее и выгоднее, чем π-связь.
| Выводы: |
1. Ковалентными связями соединяются друг с другом атомы неметаллических элементов.
2. Ковалентная связь образуется с помощью одной, двух, или трех общих электронных пар за счет неспаренных электронов.
3. Связь между атомами с помощью одной общей пары называется одинарной (простой), двух пар – двойной, трех пар – тройной.
4. Одинарная ковалентная связь всегда является σ–связью, двойная состоит из одной σ–связи и одной π-связи, тройная же связь состоит из одной σ–связи и двух π-связей.
| §13. Ковалентная полярная и неполярная связь. Свойства ковалентной связи |
Ковалентная связь устанавливается между атомами не только одного элемента-неметалла, но и разных элементов-неметаллов с близкими значениями электроотрицательности (∆ ОЭО < 2). Примером таких соединений могут служить молекулы фтороводорода и хлороводорода, воды, аммиака, оксида углерода (IV).
Вспомним, как образуется химическая связь в молекуле хлороводорода:
| Сl |
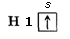


В данном случае перекрываются сферическая s-орбиталь атома водорода и гантелеобразная p-орбиталь атома хлора. Эта химическая связь также ковалентная. Она осуществляется общей электронной парой, в образовании которой каждый из этих атомов поставляет по одному электрону. Так как электроотрицательность хлора несколько больше электроотрицательности водорода, общая электронная пара оказывается смещенной к атому хлора. Этот атом приобретает небольшой отрицательный заряд, который меньше единицы (он равен –0,2), а атом водорода – такой же заряд по значению, но положительный (+0,2). Дробные заряды на атомах обозначаются греческой буквой δ («дельта») вместе со знаком «плюс» или «минус». Такую химическую связь называют полярной. Полярность ковалентной связи в схемах изображают так:
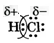
| Ковалентную связь, в которой одна или несколько общих электронных пар смещены к одному из атомов, называют полярной связью, а при отсутствии такого смещения – неполярной. |
Сравнивая значения электроотрицательности двух связанных атомов, можно оценить полярность ковалентной связи между ними. Чем больше разность электроотрицательностей (∆ОЭО), тем сильнее общая электронная пара смещена к более электроотрицательному атому и тем полярнее ковалентная связь. Например, в ряду галогеноводородов HF – HCl – HBr – HI полярность связи закономерно уменьшается: самая полярная связь в молекуле HF (∆ОЭО = 3,98 – 2,20 = 1,78), а наименее полярная – в молекуле HI (∆ОЭО = 2,66 – 2,20 = 0,46). Во всех этих молекулах общая электронная пара смещена к атому галогена.
Помимо полярности ковалентная химическая связь характеризуется и некоторыми другими свойствами. Длиной связи называют расстояние между ядрами связанных атомов. Атомы сближаются на такое расстояние, при котором достигается наибольшее перекрывание их электронных орбиталей, а энергия молекулы становится минимальной. Длина связи сравнима с размерами атомов и обычно составляет 0,1 – 0,2 нм. Самая маленькая длина связи в молекуле водорода Н2 – 0,076 нм, так как атом водорода имеет наименьший
| |
| Рис. Сравнение длин связи (в нанометрах) в некоторых молекулах |
Молекулу Н2 невозможно разглядеть даже в электронный микроскоп. Известны и гораздо более крупные молекулы. Примером может служить молекула ДНК, ответственная за передачу наследственной информации в растительных и животных клетках. В клетке молекла ДНК содержится в свернутом виде, образуя хромосомы. Если бы удалось ее раскрутить, получилась бы тончайшая нить длиной в человеческий рост при диаметре всего 2 нм.
Ковалентная связь образуется между двумя атомами, т. е. характеризуется направленностью. Если один атом образует несколько связей, то они направлены под определенным углом друг к другу. Угол между связями (валентный угол) – это угол между линиями, соединяющими химически связанные атомы. Валентные углы в молекулах бывают разные: от 90 до 1800С. Зная все валентные углы и длины всех связей, можно определить геометрическую форму молекулы.
| |
| Рис. Валентные углы в некоторых молекулах |
Алгоритм составления схемы образования химической связи:
1. Записать формулу вещества.
| H2О– вода |
2. Определить по номеру периода номер последнего энергетического уровня, по номеру группы количество валентных электронов. По количеству валентных электронов определить характер свойств элемента. Определить тип связи (по разнице в ОЭО)
H– 1 валентный электрон  неМе (искл), О – 6 валентных электронов неМе (искл), О – 6 валентных электронов  неМе
ОЭО (Н) = 2,1, ОЭО(Сl) = 3, ∆ ОЭО = 3,44 – 2,1 = 1,34 неМе
ОЭО (Н) = 2,1, ОЭО(Сl) = 3, ∆ ОЭО = 3,44 – 2,1 = 1,34 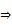 х. св. ковалентная х. св. ковалентная
|
3.
 О 2 О 2 
|
4.
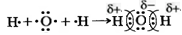
|
5.
| Н – О – Н |
6.
| |
| σ–связь |
| Выводы: |
1. При соединении атомов химических элементов-неметаллов с одинаковой электроотрицательностью смещения общей электронной пары не происходит и образуется ковалентная неполярная связь.
2. Если ковалентная связь образуется между атомами различных элементов-неметаллов с различной электроотрицательностью (∆ ОЭО < 2), то атомы приобретают небольшие заряды. Их появление вызвано смещением общей электронной пары к атому с большей электроотрицательностью. Такую ковалентную связь называется полярной.
| § 14. Молекулярная и атомная кристаллические решетки. |
| Рис. Модель кристаллической решетки иода |
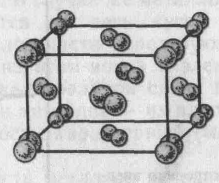
|
Твердое и жидкое состояние молекулярных веществ существует
благодаря тому, что молекулы притягиваются друг к другу. Это явление называется межмолекулярным взаимодействием.
В отличие от прочных ковалентной и ионной связей взаимодействие между молекулами довольно слабое.
Физические свойства молекулярных соединений. Вследствие того что молекулы слабо притягиваются друг к другу, вещества молекулярного строения существенно отличаются
| Рис. Модель кристаллической решетки углекислого газа |
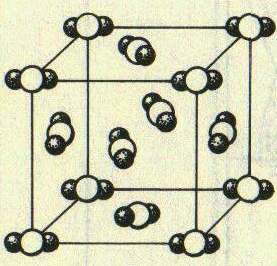
|
Молекулярные вещества при обычных условиях могут находиться в газообразном, жидком или твердом агрегатном состоянии. Агрегатное состояние зависит от относительной молекулярной массы вещества. Чем больше относительная молекулярная масса, тем больше межмолекулярное взаимодействии и меньше расстояние между молекулами, а значит, выше плотность. Молекулярные вещества с низкой молекулярной массой при обычных условиях газообразны.
Жидкие и твердые молекулярные вещества летучи. Немало молекулярных веществ имеет
запах. Всем хорошо известен резкий запах оксида серы(IV), или сернистого газа SO2; вещество образуется при зажигании спички (сера входит в состав ее головки). Газ аммиак NH3 также легко узнать по запаху. Он выделяется из водного раствора этого соединения – нашатырного спирта. Нельзя перепутать с другими запах уксусной кислоты СН3СООН, раствор которой (уксус) используют в кулинарии.
У веществ с молекулярной кристаллической решеткой отсутствует пластичность. При деформации кристаллической решетки, слои смещаются относительно друг друга, при этом слабые межмолекулярные связи разрушаются.
Вещества с молекулярной решеткой имеют небольшую механическую прочность и сравнительно низкие температуры кипения и плавления. Наличие этих свойств обусловлено тем, что силы притяжения между молекулами в кристаллах этих веществ и недостаточно прочные и сравнительно легко разрываются при внешних воздействиях.
Некоторые молекулярные вещества при нагревании переходят из твердого агрегатного состояния в газообразное, минуя жидкое. Такое явление называется сублимацией. Этим свойством обладают, например, иод, углекислый газ.
Твердый оксид углерода (IV) называют «сухим льдом». При повышении температуры он превращается не в жидкость, а в газ (углекислый), т. е. не тает, а испаряется (высыхает). Сухой лед раньше использовали в торговле для охлаждения мороженого.
Обычный лед при температуре ниже 00С также превращается в пар, правда, медленно. Благодаря этому сырое белье высыхает и на морозе.
Молекулярные вещества не проводят тепло и электрический ток (являются диэлектриками), это объясняется тем, что электроны, осуществляющие ковалентную связь между атомами в молекуле, по кристаллу не перемещаются.
Растворимость веществ с молекулярной кристаллической решеткой зависит от поляр- ности ковалентной связи. Вещества с ковалентной полярной связью хорошо растворяются в воде, вещества с неполярной связью в воде практически не растворяются. Вода поляр ный растворитель (в ее молекуле между атомами ковалентная полярная связь), поэтому в
воде хорошо растворяются вещества с ковалентными полярными и ионными связями. Молекулярное строение характерно для очень многих веществ. Однако большинство из них составляют органические вещества. Что касается неорганических веществ, то молеку-
лярное строение характерно только для некоторых из них.
Подавляющее большинство неорганических веществ составляют кристаллы, образованные сочетанием ионов или атомов, закономерно расположенных относительно друг друга.
| Рис. Модель кристаллической решетки алмаза |
| |
| Рис. Модель кристаллической решетки графита |
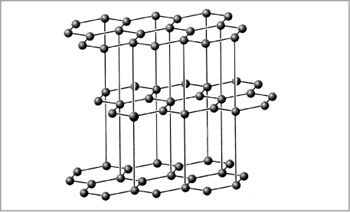
|
Физические свойства веществ с атомной кристаллической решеткой.Ковалентные связи между соседними атомами очень прочны, поэтомувсе вещества с атомной кристаллической решеткой при нормальных условиях находятся в твердом агрегат
| Рис. Модель кристаллической решетки кварца |
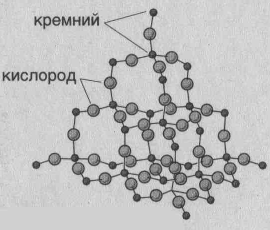
|
Пластичность у веществ с атомной кристаллической решеткой отсутствует. Если под действием деформирующей силы слои кристаллической решетки смещаются друг относительно друга, ковалентная связь (общая электронная пара) при этом разрушается.
| Деформирующая сила |
| Линяя разлома |
При обычных условиях электроны по кристаллу практически не перемещаются, поэтому
электрическая проводимость веществ с атомной кристаллической решеткой ничтожна ма-
ла. Это диэлектрики.
В воде вещества с атомной кристаллической решеткой практически не растворяются.
Как видно, разное строение веществ приводит к существенным различиям в свойствах. До начала XX века в науке господствовало представление о том, что «все вещества состоят
из молекул». Исследования, проведенные в первые десятилетия прошлого века, убедительно доказали, что в кристаллах большинства неорганических веществ (ионных, атомных, металлических) молекул нет. Поэтому нельзя допускать таких выражений, как «молекула хлорида натрия», «молекула оксида меди» и т. д., если речь идет об этих веществах, находящихся в твердом состоянии. В газообразном состоянии эти вещества могут быть в виде как молекул, так и отдельных атомов, ионов и других частиц.
| Выводы: |
1. Межмолекулярное взаимодействие возникает между любыми молекулами, как полярными, так и неполярными. Молекулы притягиваются друг к другу довольно слабо. Связанные молекулы образуют молекулярные кристаллы (молекулярную кристаллическую решетку).
2. Вещества молекулярного строения имеют низкие температуры кипения и плавления, летучи, непластичны, диэлектрики.
3. Кристаллические структуры, построенные из атомов, связанных друг с другом ковалентными связями, называют атомными кристаллами, а кристаллическую решетку атомной.
4. Вещества с атомной кристаллической решеткой твердые, нелетучие, тугоплавкие, непластичные с высокой механической прочностью, диэлектрики, практически нерастворимы в воде.
| § 15. Металлическая химическая связь и металлическая кристаллические решетки. |
Особенности строения атомов химических элементов-металлов. У атомов элементов-металлов на последнем энергетическом уровне небольшое количество электронов (один, два, реже три или четыре). Радиус атома металла больше, чем радиус атома неметалла, если элементы находятся в одном периоде и их атомы имеют одинаковое количество энергетических уровней. Поэтому валентные электроны металлов гораздо слабже притягиваются к ядру, чем валентные электроны атомов неметаллов.
Образование металлической химической связи.Валентных электронов у атома металла явно недостаточно, чтобы с другим атомом образовать прочную связь и достичь устойчивой восьмиэлектронной конфигурации (как в случае образования ковалентной связи).
Экспериментально доказано, что в парообразном состоянии некоторые металлы находятся в виде двухатомных молекул с ковалентной связью, например Li2. При образовании общей электронной пары, связывающей атомы лития
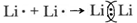
не достигается устойчивая структура внешнего слоя. Следовательно, молекулярное состояние для металлов не является энергетически выгодным. Очевидно, что для металлов характерен иной вид химической связи.
Итак, внешних и особенно неспаренных электронов у атомов металлов явно не достаточно, чтобы образовать устойчивую восьмиэлектронную конфигурацию атома. В этом случае для ее образования требуются электроны множества атомов металлов, которые «сбрасывают» свои неспаренные электроны в общее пользование. Эти электроны оказываются принадлежащими всем участвующим в этом процессе атомам. Между ними устанавливается связь, называемая металлической.Ее обеспечивают свободно перемещающиеся в объеме металла электроны, принадлежащие всем атомам, в виде «электронного газа».
| Металлическая связь– это химическая связь между атомами металла, осуществляемая с помощью общих свободно перемещающихся электронов, принадлежащих всем атомам. |
Атомы металла, «сбросившие» валентные электроны, превращаются в положительно заряженные ионы – катионы, которые могут вновь притягивать к себе электроны из электронного газа и превращаться в нейтральные атомы:
Ме0 – ne  Men+
Men+
Следовательно, система «атом – ион» очень подвижна.
Металлическая связь характерна для типичных металлов в твердом и жидком состояниях, для их сплавов и их интерметаллических соединений, образованных атомами разных металлических элементов.
Металлическая связь имеет некоторое сходство с ковалентной связь, поскольку основана на обобществлении валентных электронов. Однако при ковалентной связи обобществлены валентные неспаренные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы.
| Рис. Схема металлической кристаллической решетки |
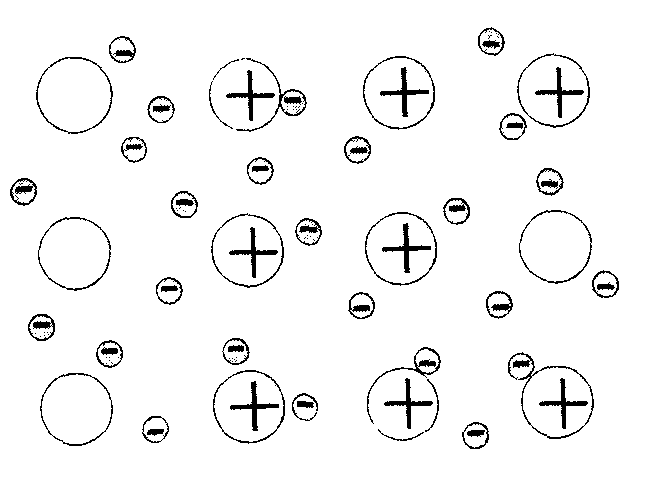
|
Наличие «свободных» электронов, или «электронного газа», в кристалле металла экспериментально доказано следующими опытами. При резком торможении быстро вращающегося куска металла появляется электрический ток. Он возникает также при резком ускорении движения куска металла.
Металлическую кристаллическую решетку имеют все металлы и все сплавы, даже если в состав сплава входит неметалл.
Физические свойства металлов.Металлы, кроме ртути, при обычных условиях – твердые вещества. Все металлы обладают металлическим блеском. Металлический блеск металлов объясняется способностью их кристаллов хорошо отражать свет (в мелко раздробленном состоянии металлы имеют обычно черный цвет и не блестят). Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала.
Отраженный поверхностью металлов свет определяет их цвет. Белый и серый цвета большинства металлов говорят о том, что металлы рассеивают в равной степени все лучи видимой части спектра. А вот золото и медь в большей степени поглощают лучи с короткой длиной волны (близкие к фиолетовым лучам) и отражают длинноволоновые лучи, поэтому окрашены соответственно в желтый и желто-красный цвета.
Температуры плавления металлов разнообразны. Самый легкоплавкий металл – ртуть (tпл = –380С), самый тугоплавкий – вольфрам (tпл = 33900С). Это свойство вольфрама используется для изготовления ламп накаливания. К тугоплавким относятся металлы с температурой плавления 10000С.
По плотности металлы можно разделить на легкие (плотность менее 5 г/см3) и тяжелые, плотность которых более 5 г/см3. Чем меньше относительная атомная масса, тем он легче. Так самый легкий металл литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,6 г/см3).
Легкие металлы обычно легкоплавки, цезий и галлий могут плавиться уже на ладони руки, а тяжелые металлы – тугоплавкие.
Металлы различаются и по твердости. Самый твердым является хром; им можно резать стекло. Самые мягкие металлы – натрий, калий, свинец.
| Пластичность – это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия. |
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. При механической обработке металла слои кристаллической решетки сдвигаются друг относительно друга. Однако металлическая связь при этом не разрушается, поскольку ее обеспечивают общие электроны, выступая своеобразной смазкой между слоями.
| Деформирующая сила |
Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий. А из одного грамма золота можно вытянуть проволоку в 3 км.
Хорошая электропроводность и теплопроводность металлов объясняется присутствием «свободных» электронов, которые в электрическом поле, направленно перемещаются от отрицательного полюса к положительному.
При охлаждении электропроводность металлов растет и вблизи абсолютного нуля перехо
дит в сверхпроводимость. Лучшими проводниками электричества являются серебро, медь и алюминий. Медь и алюминий используют для изготовления электропроводов.
Теплопроводность металлов объясняется высокой подвижностью свободных электронов. Если нагревать кусок металла с одной стороны, то при повышении температуры ионы и атомы в узлах кристаллической решетки начинают колебаться быстрее. Сталкиваясь с колеблющимися в узлах кристаллической решетки ионами и атомами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов и атомов при посредстве электронов передаются другим частицам, и температура металла быстро выравнивается.
Взаимосвязь между атомами, молекулами, ионами и кристаллами можно изобразить с помощью такой схемы:
| Атомы |
| Молекулы |
| Ионы |
| Ионная кр. р. Кр. р |
| Металлическая кр. р. Кр. р |
| Молекулярная кр. р. Кр. р |
| Атомная кр. р. Кр. р |
Дата добавления: 2015-10-19; просмотров: 3312;
