Понятие «валентность» применимо только к ковалентным соединениям. К ионным соединениям неприменимы понятия «валентность» и «молекула».
Степень окисления.Более универсальной характеристикой состояния атома в химическом соединении является степень окисления.
| Степень окисления– это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов. |
При определении степени окисления атомов предполагают, что все общие электронные
пары перешли к более электроотрицатальному атому. На самом деле такого полного смещения не происходит даже при взаимодействии элементов с большой разницей в электроотрицательности.
Однако условно считают такое смещение электронных пар полным не зависимо от реальной степени смещения.
Численное значение этой характеристики выражается в единицах заряда электрона и может иметь положительное, отрицательное и нулевое значение.
Количественно степень окисления определяется числом валентных электронов, смещенных от менее электроотрицательного атома в химическом соединении (положительная степень окисления) к более электроотрицательному атому (отрицательная степень окисления). Во многих случаях степень окисления численно совпадает с валентностью.Но так бывает не всегда.
Например, в молекуле азота степень окисления равна 0, так как между атомами азота
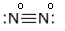
|
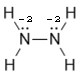
|
В молекуле аммиака связи между атомом азота и атомами водорода ковалентные полярные, электроотрицательность азота выше, чем водорода, поэтому к атому азота от атомов водорода смещены три общие электронные пары. Следовательно, степень окисления азота в этом случае равна – 3. Валентность азота по-прежнему равна III.
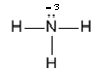
Только в последнем случае значение валентности и степени окисления совпадают (по модулю). Из выше сказанного можно сделать вывод, что значение валентности и степени окисления по модулю не совпадают, если вещество содержит ковалентные неполярные связи.
Поэтому при определении степени окисления атома в соединении рекомендуется в структурных формулах электронные пары, которые в равной мере приналежато двум атомам, изображать черточкой, а те, которые смещены к атому более электроотрицательного элемента, — стрелкой. Например, в молекуле пероксида водорода Н2О2 степень окисления кислорода равна –1, а валентность II:
| Выводы: |
1. Валентность – это способность атомов химического элемента образовывать определенное количество ковалентных связей (общих электронных пар)
2. У валентности нет заряда.
3. Валентность зависит от количества неспаренных электронов.
4. Степень окисления это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
5. Положительная степень окисления равна количеству отданных электронов, отрицательная степень окисления равна количеству принятых электронов.
6. Как правило, значение степени окисления и валентности совпадают по модулю. Этого не происходит только в том случае, если в веществе есть ковалентная неполярная связь.
| § 18. Постоянная и переменная валентность. Валентные возможности. |
Анализируя состав и строение веществ, образованных одним и тем же элементом, нетрудно убедиться, что большинство элементов могут иметь несколько разных значений валентности, т. е. обладают переменной валентностью.
Например, угарныйгаз СО образуется при сгорании веществ, содержащих углерод, в условиях недостаточного притока воздуха. В этом оксиде углерод двухвалентен, так как валентность кислорода равна II. Если же кислорода будет избыточное количество, то образуется углекислый газ СО2, в котором углерод четырехвалентен.
| Переменная Все остальные элементы |
| Постоянная 1) Для эл-тов I-III групп главных подгрупп В = № группы 2) В (О) = II; В(Н) = I; B (F) = I. |
| Валентность |
| Высшая = № группы в ПС |
| Низшая = 8 – № группы в ПС |
Способность элементов проявлять то или иное значение валентности определяется строе
нием их атомов. Вспомним, что валентность определяется числом неспаренных электро
нов.
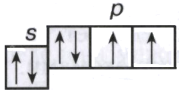
|
2s2 2p4:
Из электронно-графической схемы последнего энергетического уровня кислорода следует, что атом кислорода имеет два неспаренных электрона, а значит, он может образовать только две общие электронные пары (химические связи) с другими атомами, поэтому проявляет валентность равную II.
Углерод– элемент главной подгруппы IVгруппы. Электронная конфигурация углерода
1s2 2s2 2p2. Валентные электроны – 2s2 2p2:
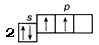
Атом углерода содержит два неспаренных электрона, а значит, он может образовать только две общие электронные пары (химические связи) с другими атомами, поэтому проявляет валентность равную II. Однако этот элемент в своих соединениях проявляет, кроме валентности II, валентность IV. Значит, в атоме углерода должно быть не два, а четыре неспаренных электрона. Они появляются в результате распаривания пары 2s-электронов: один из электронов, получив порцию энергии, переходит на вакантную (свободную)
p-орбиталь.
Процесс перехода электрона с одной орбитали на другую (в пределах одного энергетического уровня) называют возбуждениеатома. Возбужденное состояние атома обозначают звездочкой сверху после знака элемента.
| |
1s2 2s2 2p2 → 1s2 2s1 2p3

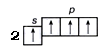
| основное состояние возбужденное состояние атома углерода атома углерода |
Таким образом, для углерода характерны валентности II и IV.
Обратите внимание, что в атомах водорода и кислорода нет вакантных орбиталей. Поэтому распаривание пар 2s- и 2p-электронов невозможно, эти элементы проявляют постоянную валентность.
В любом случае у элементов второго периода максимальная валентность не может быть больше четырех, так как на внешнем энергетическом уровне у атомов этих элементов всего четыре орбитали, и следовательно, атомы максимально могут образовать не больше четырех ковалентных связей.
Сера, как и кислород, – элемент главной подгруппы VI группы, но находится в третьем периоде. Электронная конфигурация кислорода 1s2 2s2 2p6 3s2 3p4. Валентные электроны – 3s2 3p4:
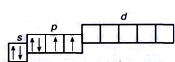
| |
S → S
3s2 3p4 → 3s2 3p3 3d1

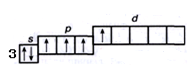
В результате этого общее количество неспаренных электронов увеличивается до четырех. В таком состоянии атом серы четырехвалентен.
При поглощении дополнительной энергии распаривается и вторая пара электронов – один 3s-электрон переходит на следующую вакантную d-орбиталь:
3s2 3p3 3d1 → 3s1 3p3 3d2

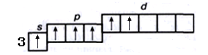
В результате этого общее количество неспаренных электронов увеличивается до шести – атом серы шестивалентен. Итак, для серы возможны валентности II, IV и VI.
| Выводы: |
1. В зависимости от строения атома элементы проявляют постоянную или переменную валентность.
2. Атом при наличии свободных орбиталей на последнем энергетическом уровне может переходить в возбужденное состояние. При этом за счет распаривания электронных пар количество неспаренных электронов в атоме возрастает и атом проявляет более высокую валентность.
3. В случаях переменной валентности высшее ее значение равно номеру группы. Значение низшей валентности элементов-неметаллов равно разности (8 – № гр).
Дата добавления: 2015-10-19; просмотров: 3079;
