Положение элементов в Периодической системе Д. И. Менделеева и типы кристаллических решеток их простых веществ.
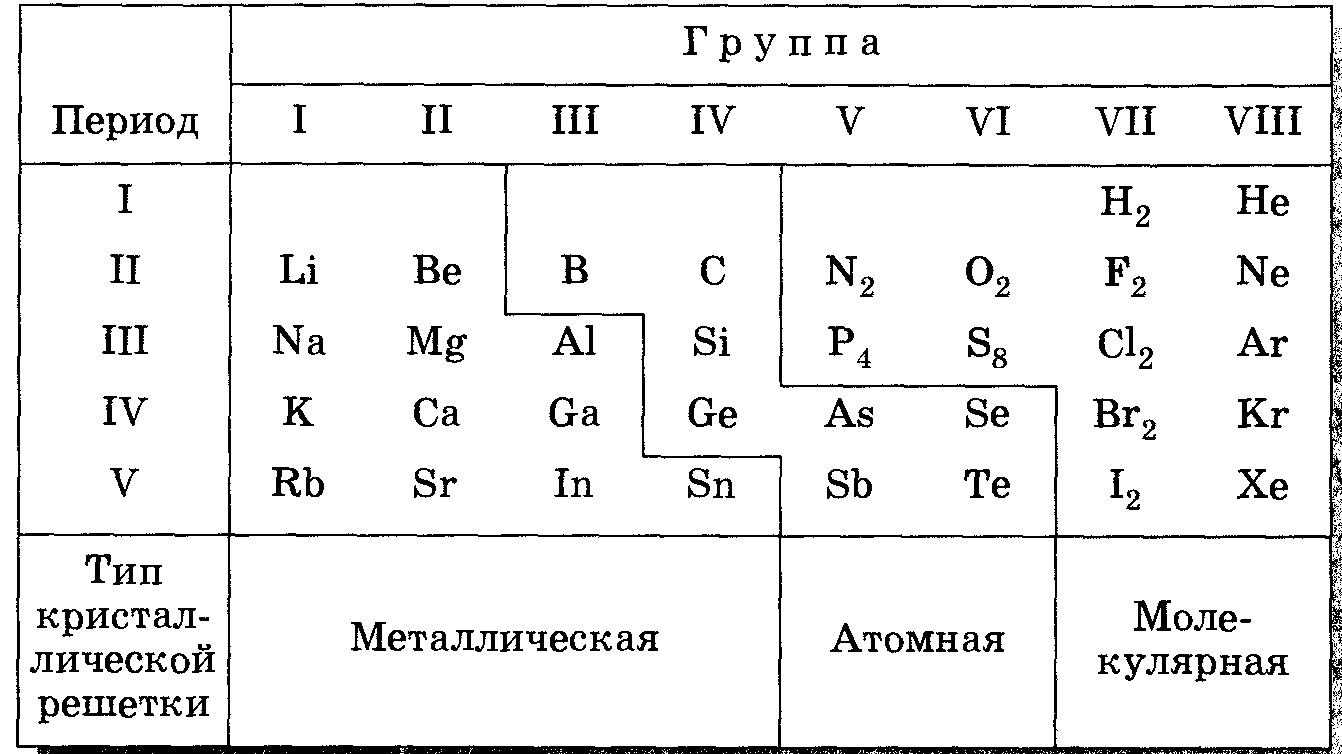
| Выводы: |
1. Химически элементы-металлы образуют простые вещества-металлы. Каждый атом в металле теряет валентные электроны и превращается в положительно заряженный ион (катион). Такие электроны начинают хаотически перемещаться в кристалле, т. е. становятся общими.
2. Связь между атомами металла с помощью общих электронов, называется металлической.
3. Своеобразие металлической связи и металлической решетки обуславливает и объясняет общие физические свойства металлов: металлический блеск, пластичность, электро- и теплопроводность.
| § 16. Соотношение между различными типами химической связи. |
Мы познакомились с различными типами химической связи. Природа их едина: электростатическая она связана с электрическими взаимодействиями электронов и ядер атомов.
Соединения ионного и ковалентно-полярного типа образованы атомами разных элементов с разной электроотрицательностью. В этих соединениях электронные пары, связывающие атомы, смещены к более электроотрицательному элементу. Наиболее полное смещение электронной пары или пар имеет место в ионных соединениях. Отдавая электроны атомы металла переходят в положительные заряженные ионы – катионы, а атомы типичного неметалла, принимая электроны, переходят в отрицательно заряженные ионы – анионы. Разноименные ионы связываются электростатическими силами в ионное соединение. Однако экспериментальные исследования доказывают, что полного перехода электронов металлов к атомам неметаллов не происходит. Поэтому в хлориде натрия (Na+Cl—) заряды его ионов не равны единице, а имеют в действительности заряды на ионах, равные + 0,8 и – 0,8 (реальные заряды на ионах называются эффективными зарядами). Даже в предельно ионном соединении – фториде франция – FrF эффективные заряды на ионах соответственно равны + 0,94 и – 0,94. Эти факты говорят о том, что полного отторжения электронов от атомов металлов не происходит, а имеет место лишь более или менее сильное оттягивания связывающего электронного облака от атома металла к атому неметалла.
Чем больше разность между значениями относительной электроотрицательности (ОЭО) атомв, тем выше степень ионности их соединения. Связи с разностью ОЭО больше 2 можно отнести к ионным (более 50% ионности)
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи. Экспериментальное изучение электронной плотности веществ, образованных разными типами связей, доказывает это суждение. Чисто ионной связи практически не существует. Отсюда деление химической связи на типы – ковалентная и ионная – также условно.
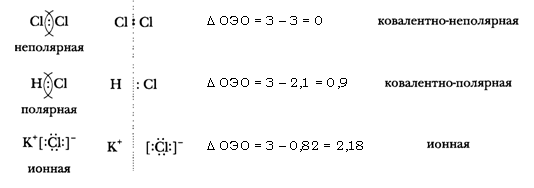
Металлическая связь совмещает ковалентное взаимодействие с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
Различные типы связи могут содержаться в одних и тех же веществах, например:
1) в основаниях – между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой – ионная;
2) в солях кислородсодержащих кислот – между атомами неметалла и кислородом кислот
ного остатка – ковалентная полярная, а между металлом и кислотным остатком – ионная;
3) в пероксидах металлов, например, Na2O2 (Na – O – O – Na) – связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом – ионная и т. д.
| Выводы: |
1) Причиной единства всех типов и видов химических связей служит их одинаковая
физическая природа – электронно-ядерное взаимодействие.
2) Образование химической связи в любом случае сопровождается выделением энергии.
| § 17. Валентность. Соотношение понятий «валентность» и «степень окисления». |
Валентностью характеризуется способность атомов химических элементов к образованию химических связей.
Сравним модели молекул фтороводорода, воды, аммиака и метана. Атомы фтора, кислорода, азота, углерода в этих молекулах связаны с разным числом атомов водорода.
| С |
| N |
| О |

Как видно из приведенных примеров, атомы химических элементов фтора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определенное число атомов водорода. Таким же свойством обладают и атомы других элементов в различных соединениях.
| Валентность –это свойство атомов химического элемента присоединять определенное количество атомов другого химического элемента. |
Атомы водорода не могут присоединять более одного атома другого элемента, поэтому валентность водорода принята за единицу. Валентность же других элементов можно выразить числом, показывающим, сколько атомов водорода может присоединить к себе атом данного элемента. Например, в молекуле фтороводорода атом фтора присоединил к себе один атом водорода, следовательно, фтор одновалентен. Валентность кислорода равна двум (II), ибо его один атом присоединяет два атома водорода. Азот в молекуле аммиака трехвалентен (III), а углерод – четырехвалентен (IV).
Дата добавления: 2015-10-19; просмотров: 2366;
