В бинарном соединении суммарная валентность всех атомов одного элемента равна суммарной валентности всех атомов другого элемента.
Например, в оксиде углерода СО2 валентность атома углерода равна суммарной валентности двух атомов кислорода.
| С О2 |
| IV II |
| (4 • 1) = (2 • 2) 4 = 4 |
Cверху римскими цифрами показана валентность каждого элемента, внизу -- суммарная валентность.
Руководствуясь правилом суммарной валентности, можно определить валентность химического элемента в соединении по известной валентности другого элемента. Например, определим валентность железа в оксиде железа Fe2O3, зная валентность кислорода (II). Суммарная валентность трех атомов кислорода равна 2 • 3 = 6. Суммарная валентность двух атомов железа также равна 6. Следовательно, валентность одного атома железа
| Fe2 О3 |
| III II |
| (2 • 3) = 6 6 : 2 = 3 |
Запомните, что водород всегда одновалентен (валентность I), кислород всегда двухвалентен (валентность II)
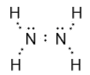
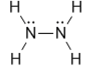
С развитием учения о химической связи под валентностью атома в молекуле стали понимать число общих электронных пар, которыми данный атом связан с другими атомами. Число же электронных пар (связей), которые атом может образовать, равно числу его неспаренных электронов. При этом не учитывается полярность образовавшихся связей, а поэтому валентность не имеет знака.
| Валентность –это способность атомов химического элемента образовывать определенное количество ковалентных связей (общих электронных пар) |
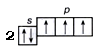
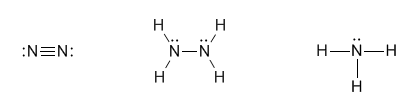
Рассмотрим эти положения на примере азота N2 , гидразина N2Н4, аммиака NН3.
Строение последнего энергетического уровня атома азота следующее:

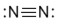
|
|
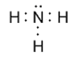
|
Дата добавления: 2015-10-19; просмотров: 1474;
